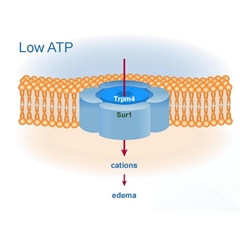
SUR1-TRPM4通道是一种非选择性的阳离子通道,仅在缺血、缺氧和创伤条件下才在中枢神经系统中表达。该通道开放,能够导致发生细胞毒性水肿、胀亡,以及血管性水肿。从而造成脑水肿。因此阻断SUR1-TRPM4通道,能够抑制脑水肿的发生。
2001年,M Chen和J M Simard报道在新鲜分离的天然反应性星形胶质细胞存在一种Ca2+激活ATP敏感性非选择性阳离子通道,该离子通道在钙离子的刺激下开放,并能够被ATP拮抗。耗竭ATP,导致该离子通道开放后,会造成细胞肿胀和细胞膜起泡(M Chen.,2001)。
同年,X Z Xu等人报道实现瞬时受体电位M通道(TRPM)家族TRPM4的克隆(X Z Xu., 2001)。
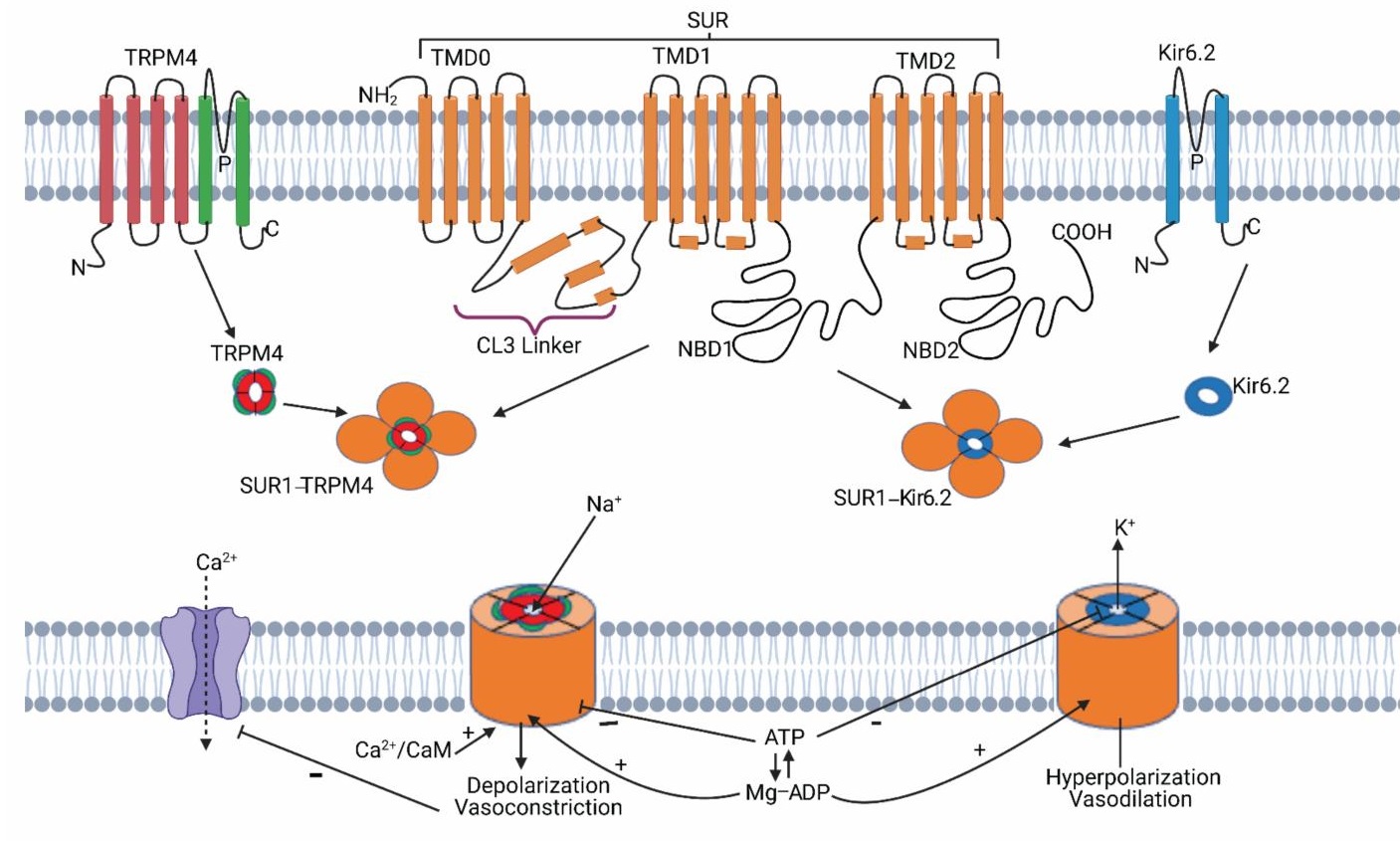
2003年,Mingkui Chen等人的研究显示,新鲜分离天然反应性星形胶质细胞中的Ca2+激活ATP敏感性非选择性阳离子通道与磺酰脲受体1(SUR1)偶联,受SUR1的调控,SUR1拮抗剂格列本脲(Glibenclamide)能够阻止该通道的开放,并阻止耗竭ATP引起细胞发生肿胀(Mingkui Chen., 2003)。
2006年,J Marc Simard等人证实恶性脑水肿会导致SUR1的表达上调,使用低剂量对血糖的影响很小的格列本脲也能够降低恶性脑水肿实验模型的死亡率、脑水肿体积和梗死体积(J Marc Simard., 2006)。
2007年,J Marc Simard等人研究显示,脊髓损伤会导致SUR1的表达上调,SUR1上调调节Ca2+激活ATP敏感性非选择性阳离子通道,参加到脊髓损伤引起的进行性出血性坏死,阻断SUR1,能够防止脊髓损伤引起的继发性毛细血管破裂(J Marc Simard.,2007)
同年,J Marc Simard等人推测该Ca2+激活ATP敏感性非选择性阳离子通道为TRPM4(J Marc Simard., 2007)
2009 年,Volodymyr Gerzanich 等人研究显示,脊髓损伤会导致毛细血管中TRPM4的表达上调,TRPM4的表达上调,进而造成细胞水肿,毛细血管破裂,扩大损伤,而阻断TRPM4能够留了毛细血管结构的完整性,消除了继发性出血,减少病灶体积,改善神经功能 (Volodymyr Gerzanich., 2009)。
尽管上述研究提出SUR1-TRPM4在神经血管创伤中发挥作用,但直到2013年,Seung Kyoon Woo等人最终确定和SUR1偶联的Ca2+激活ATP敏感性非选择性阳离子通道为TRPM4。4个SUR1和4个SUR1形成8聚集结构,SUR1 与 TRPM4 的结合增强了TRPM4 对于Ca2+离子的亲和力(Seung Kyoon Woo., 2013)。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3