Ampligen(通用名Rintatolimod)属于错配dsRNA,为TLR3激动剂。TLR3是一种膜受体,能够介导干扰素 、促炎细胞因子和趋化因子的转录表达。Ampligen在ME/CFS 、抗病毒和抗肿瘤等领域都显示出治疗作用。
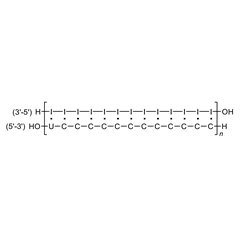
结构:
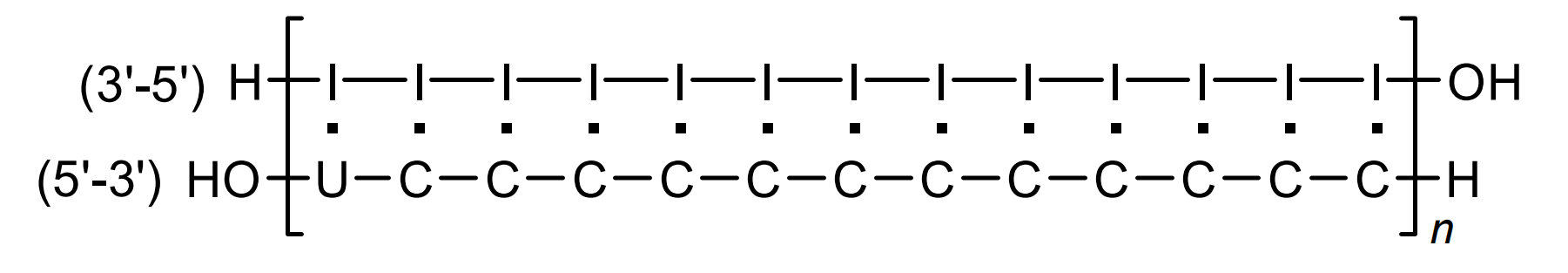
介绍:
1972年William Carter等人研究发现由次黄嘌呤(I)和胞嘧啶(C)碱基构成的长链双链RNA(dsRNA)聚合物rIn·rCn能够有效刺激细胞分泌干扰素(W A Carter., 1972)。
之后Carter加入Hemispherx Biopharma,以便相关药物的商业开发。
由于rIn·rCn在初步临床试验中出现毒性反应并缺乏有有效性, 1985年Carter等人r筛选出每12个胞嘧啶碱基插入1个尿嘧啶(U)碱基的错配dsRNA药物Ampligen®——rIn·r(C12,U)n,又称poly(I:C12U)(W A Carter., 1985)。
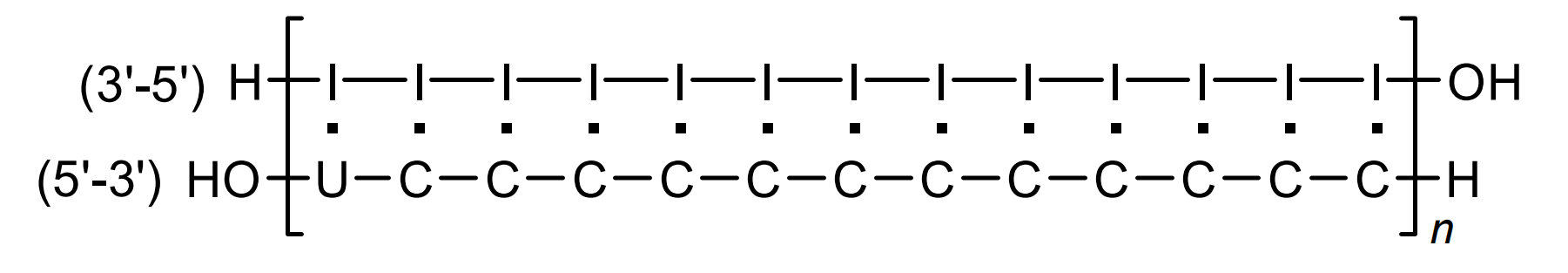
尿嘧啶碱基引入使,使得配对碱基之间的氢链稳定性变差,为核苷酸内切酶催化水解dsRNA提供起始位点。临床前研究显示Ampligen®能够提高2'-5'-寡腺苷酸合成酶(2-5A)水平(R J Suhadolnik., 1985)。2'-5'-寡腺苷酸合成酶是一种抗病毒酶,由干扰素(INF)刺激产生,能够激活核糖核酸酶L(RNase L),RNase L能够降解mRNA,从而阻止病毒的表达。此外,体外实验显示,Ampligen的抗肿瘤活性强于干扰素和rIn·rCn(W A Carter., 1985)。
2007年Brian B Gowen等人研究显示与rIn·rC不同,Toll样受体3(TLR3)对于rIn·r(C12,U)发挥作用至关重要(Brian B Gowen., 2007)。
TLR3是一种膜受体,属于Toll样受体(Toll-like receptors)家族,在神经细胞,免疫细胞,成纤维细胞和各种上皮细胞中广泛表达,介导干扰素 、促炎细胞因子和趋化因子的转录表达。rIn·r(C12,U)为TLR3激动剂。
Ampligen的早期临床试验显示9名使用10-40mg Ampligen治疗的实体瘤患者,3名患者疾病稳定期达到1年。使用 80 mg剂量的5名患者中有2名的患者出现肿瘤消退(I Brodsky., 1985)。
1987年,纳入10名艾滋病患者进行的小样本试验,初步显示Ampligen具有抗人类免疫缺陷病毒病毒(HIV)作用,也初步验证了Ampligen对于2-5A的调节作用(W A Carter., 1987)
由于一些肌痛性脑脊髓炎/慢性疲劳综合征(ME/CFS)被认为与2-5A/RNase L通路下调有关。1988年8月,Daniel Peterson博士获得FDA许可,在同情用药原则下,选择一例ME/CFS 重症患者试用Ampligen。Ampligen治疗结果令人印象深刻,治疗一年后,患者在某些方面恢复了接近正常的功能,智商提高了46分。之后Peterson 博士选择15名患者试用Ampligen。在24 周试验结束时,大多数患者表现出体能状态(Karnofsky 评分)和运动耐量(通过跑步机测试)增加,记忆力改善,和智商分数提高,受试患者未出现显著毒性反应。对Ampligen治疗无反应的几名患者,治疗前2-5A与显著改善患者相比存在差异。Peterson博士的研究,为1991年FDA批准 Ampligen更大规模的双盲临床试验铺平了道路。
由于Hemispherx投资方,杜邦Dupont的退出,Hemispherx为节约资金,将该试验由48周,减少到24周。
尽管24周、随机、多中心、安慰剂,共纳入92名ME/CFS患者的双盲对照临床研究,Ampligen 用药组与安慰剂相比,在改善Karnofsky体能评分(P < .03)、运动耐量(运动跑步机测试,P = .01)、日常生活活动能力(P < .04)、认知缺陷(P = .05),减少使用其他药物(P < .05)方面取得显著差异(D R Strayer., 1994)。但FDA以毒性研究不足由,拒绝通过快速有限批准Ampligen。
1998年Hemispherx启动了Ampligen(通用名Rintatolimod)治疗ME/CFS的3期临床试验。该研究为前瞻性、双盲临床试验,共纳入234名长期患有衰弱性 CFS/ME 的受试者。受试者随机接受一周两次200 mg的Rintatolimod或安慰剂。持续两周后,Rintatolimod组病情严重患者,接受一周两次400 mg的Rintatolimod治疗,共 40 周。40周后,安慰剂改用Rintatolimod,Rintatolimod组继续使用Rintatolimod,治疗24周。结果显示第40周Rintatolimod组安慰剂校正运动耐量(ET)与基线相比相对平均改善幅度达到21.3% (p = 0.047)。如使用剂量依从性降低的受试者进行校正,Rintatolimod组安慰剂相对ET改善幅度提高到 28% (p = 0.022)。与安慰剂相比,Rintatolimod组也显著降低了对患者常规用药物的使用量。后续24周,由安慰剂组转为Rintatolimod组的受试者,在后续24周时,ET 表现改善幅度达到39% (p = 0.04)(David R Strayer., 2012)。
2013年由于认为缺乏生物学方面的指标验证Rintatolimod的有效性,FDA再次否决批准Rintatolimod用于ME/CFS的治疗。2016年阿根廷批准Rintatolimod用于ME/CFS的治疗
之后Hemispherx Biopharma把Rintatolimod研发方向转向抗病毒和抗肿瘤领域。
2014年Edgar Turner Overton发表鼻腔内接种流感疫苗联合Rintatolimod(50μg、200μg或500μg)鼻内注射的1/2期临床试验结果。试验显示Rintatolimod联合组能够更有效促进IgA的分泌(Edgar Turner Overton., 2014)。
2019年Hemispherx Biopharma更名为AIM ImmunoTech。
2024年4月10日,AIM ImmunoTech在线公布了Rintatolimod联合顺铂及帕博利珠单抗治疗铂敏感复发性卵巢癌的2期临试验中期试验结果。联合用药的客观缓解率(ORR)达到45%,加上病情稳定患者,总临床获益率为55%,联合用药的中位数无进展生存期为7.8个月。该试验中期结果,优于帕博利珠单抗治疗复发性卵巢癌2期临床试验KEYNOTE-100的客观缓解率和无进展生存期(AIM., 2024)。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

错配dsRNA514
横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3