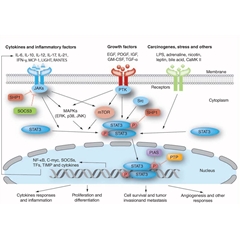
人类多种肿瘤细胞系中发现STAT3可被持续激活,STAT3激活能够介导肿瘤细胞成长,因此抑制STAT3有能够阻止肿瘤细胞生长。
1990年,X Y Fu等人报道在IFN刺激细胞后,鉴定出IFN刺激形成的转录因子,干扰素刺激基因因子 3 (ISGF3)(X Y Fu., 1990)。
1993年,K Shuai等人研究显示ISGF3由两种同源的蛋白STAT(信号传导及转录激活蛋白)1、STAT2和IRF9(干扰素调节因子9)共同组成,IFNγ能够诱导STAT酪氨酸位点发生磷酸化,调节目标基因表达(K Shuai., 1993)。
1993年,U M Wegenka等人鉴定出一种可以被白细胞介素-6(IL-6)激活的蛋白,急性期反应因子(APRF)。激活的APRF能够与IL-6反应元件结合,调节多种急性期蛋白基因的表达(U M Wegenka., 1993)。
1994年,S Akira等人克隆出APRF的氨基酸序列,显示与STAT1高度同源,因此APRF也被称为STAT3(S Akira., 1994)。
生长因子和多种细胞因激活受体后,能够使STAT3磷酸化,形成活化的二聚体,活化的二聚体参与调控目标基因的表达。
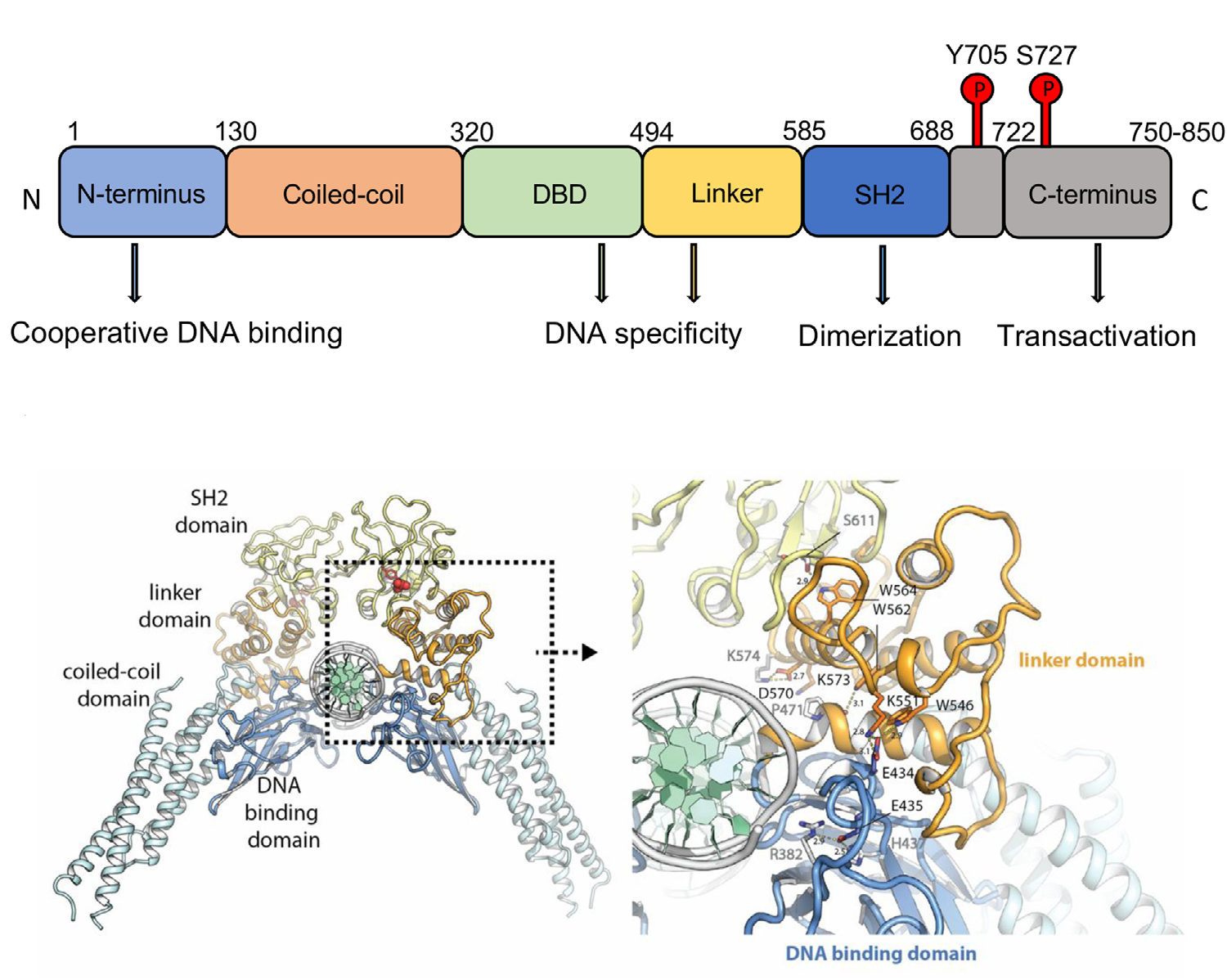
STAT3包括6个结构域,N端结构域(N‐terminal)能够介导STAT3二聚体和DNA结合;螺旋卷曲结构域(Coiled‐coil)能够协助上游受体激活后募集STAT3,使STAT磷酸化,并形成活化的二聚体;DNA结合结构域(DBD)用于识别特定的DNA序列;DBD和SH2之间的链接子,SH2结构域参加STAT磷酸化和形成二聚体,,C端结构域(N‐terminal)也称为反式激活结构域(TAD),其酪氨酸残基 (Tyr705)可发生磷酸化,使STAT3被激活。
在人类多种肿瘤细胞系中发现STAT3可被持续激活。1999年J F Bromberg等用半胱氨酸残基替换STAT3 C端的A661和N663的产物STAT3-C,能够在未被磷酸化前题下,自发形成激活状态的STAT3-C二聚体,并能够诱导实验动物出现肿瘤,验证了STAT3基因是一种致癌基因(J F Bromberg., 1999)。
1998年J R Grandis等人的研究显示表皮生长因子受体依赖于STAT3,介导细胞成长(J R Grandis., 1998)2000年J I Song等人提出,靶向STAT3有望实现抑制肿瘤(J I Song., 2000)。
第一个进入临床试验的STAT3抑制剂是Napabucasin,能够抑制STAT3被激活,尽管体外实验和动物实验均显示Napabucasin具有抗肿瘤活性,但2017年Derek J Jonker发表的Napabucasin治疗难治疗性结肠癌3期临床研究,未能证实Napabucasin能够延长患者的生存期(Derek J Jonker., 2018)
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。


横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3