
Imetelsta是寡核苷酸类端粒酶抑制剂,能够降低骨髓增生异常综合征对于输注红细胞的依赖。
结构:
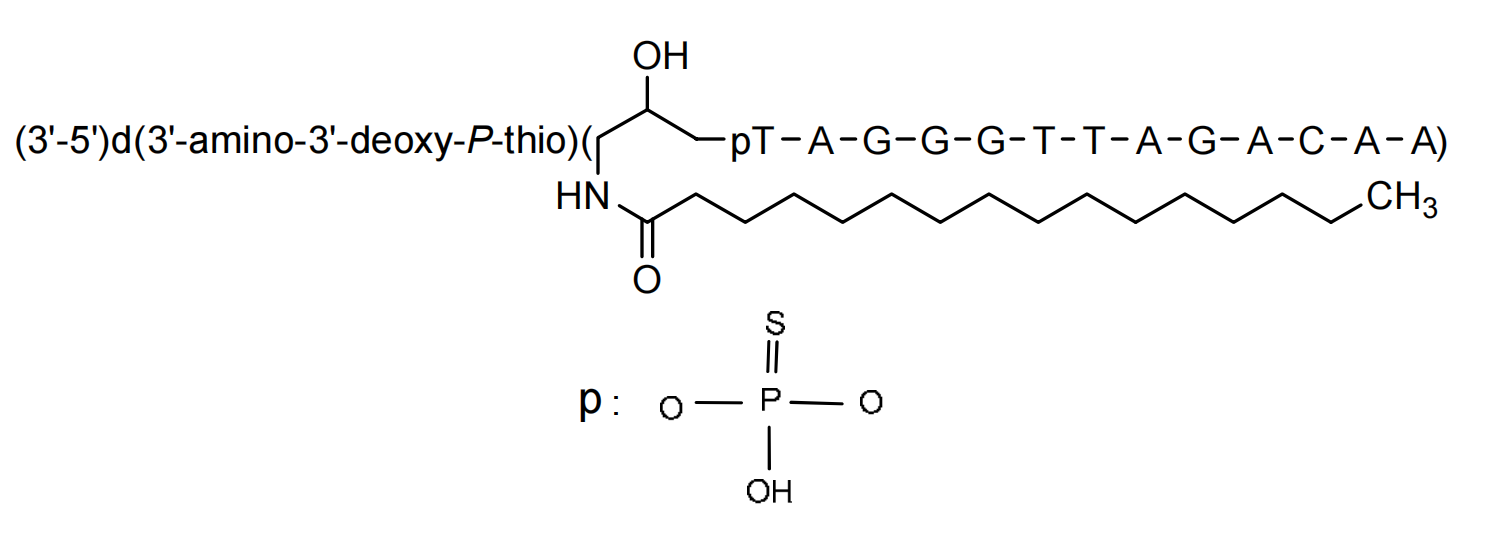
介绍:
Imetelstat(研发编号GRN163L)是Geron开发的寡核苷酸类端粒酶抑制剂。GRN163L为GRN163使用3-氨基-1,2-丙二醇作为连接子,在寡核苷酸5ʹ端硫代磷酸酯骨架上接入一条含16个碳原子的脂肪酸链得到的优化产物。通过引入脂肪酸链,增加了寡核苷酸脂溶性,改善体内分布(Brittney-Shea Herbert., 2005)。
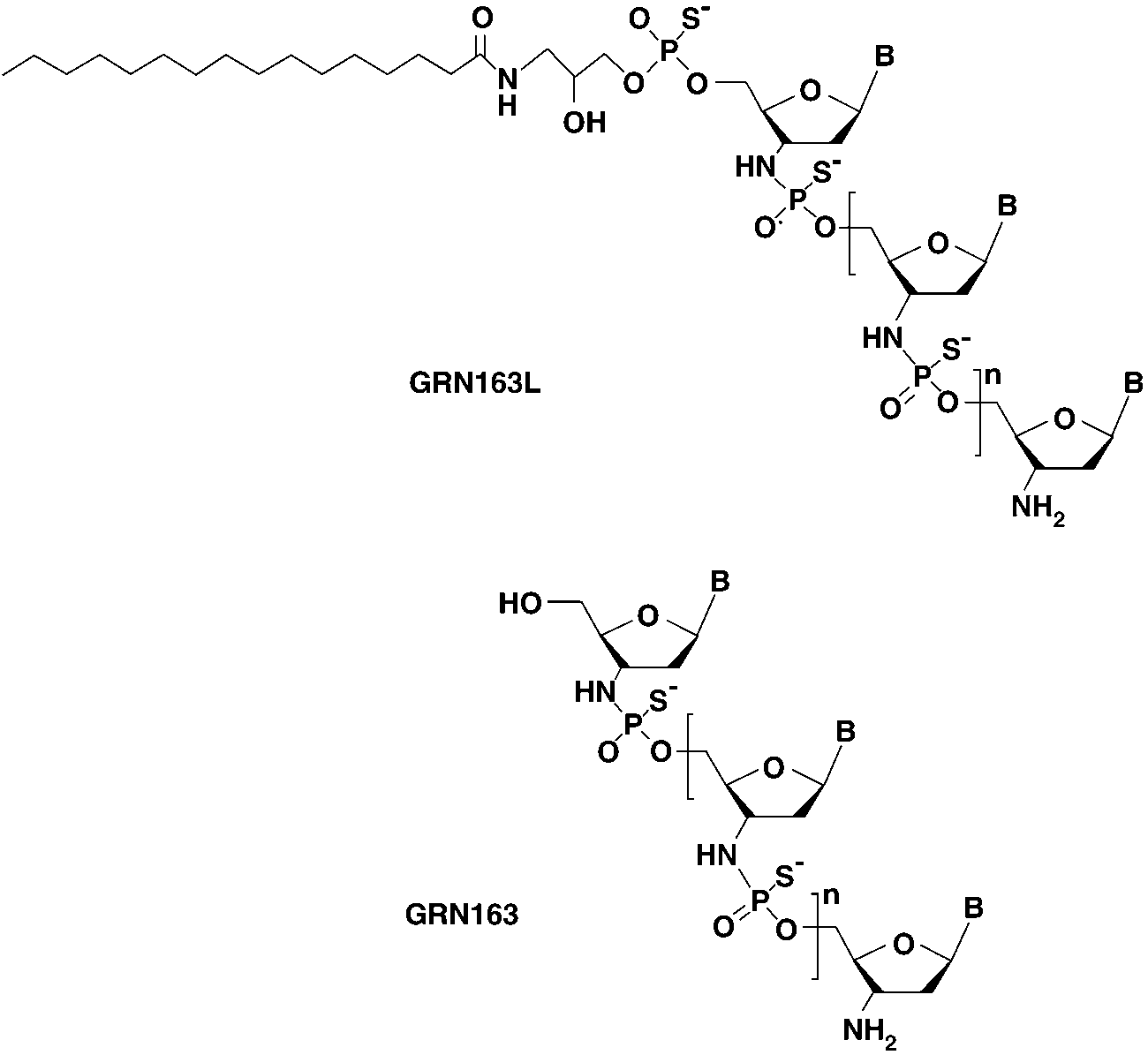
GRN163是使用硫代磷酰胺骨架,通过与端粒酶功能性RNA碱基配对,筛选得到的含有13个碱基的寡核苷。体外实验显示GRN163对端粒酶具有离良好的抑制作用(S Gryaznov., 2001)。

动物体内实验显示GRN163L能够抑制肿瘤生长并且能够增加肿瘤对于化疗的敏感性(Meta W Djojosubroto., 2005)。
1期临床试验显示GRN163L主要不良反应是中性粒细胞减少症和血小板减少症(Asher Alban Chanan-Khan., 2008)。
2015年,A A Chiappori等人发表Imetelstat治疗晚期非小细胞肺癌的2其临床试验,未能够证实Imetelstat能够改善患者的无进展生存期(A A Chiappori., 2015)。
同年,Ayalew Tefferi等人发表Imetelstat治疗骨髓增生性肿瘤相关骨髓纤维化的临床试验试验结果。结果显示21%(7例)患者实现完全或部分缓解(Ayalew Tefferi., 2015)。
2024年,Uwe Platzbecker等人发表Imetelstat用于复发或对促红细胞生成药物难治性低危骨髓增生异常综合征的3期临床试验IMerge的试验结果。 该试验为随机、双盲、安慰剂对照试验,共纳入178名患者,按2:1随机接受Imetelstat或安慰剂。试验结果显示,Imetelstat组连续8周无需红细胞输注(RBC-TI)为47例,比例为40%(95% CI 30.9-49.3)。安慰刘组为9例,比例为15.0%(95% CI 7.1-26.6)。两组之间差异为25%(95% CI 9.9-36.9),p=0.0008(PUwe Platzbecker., 2024)。
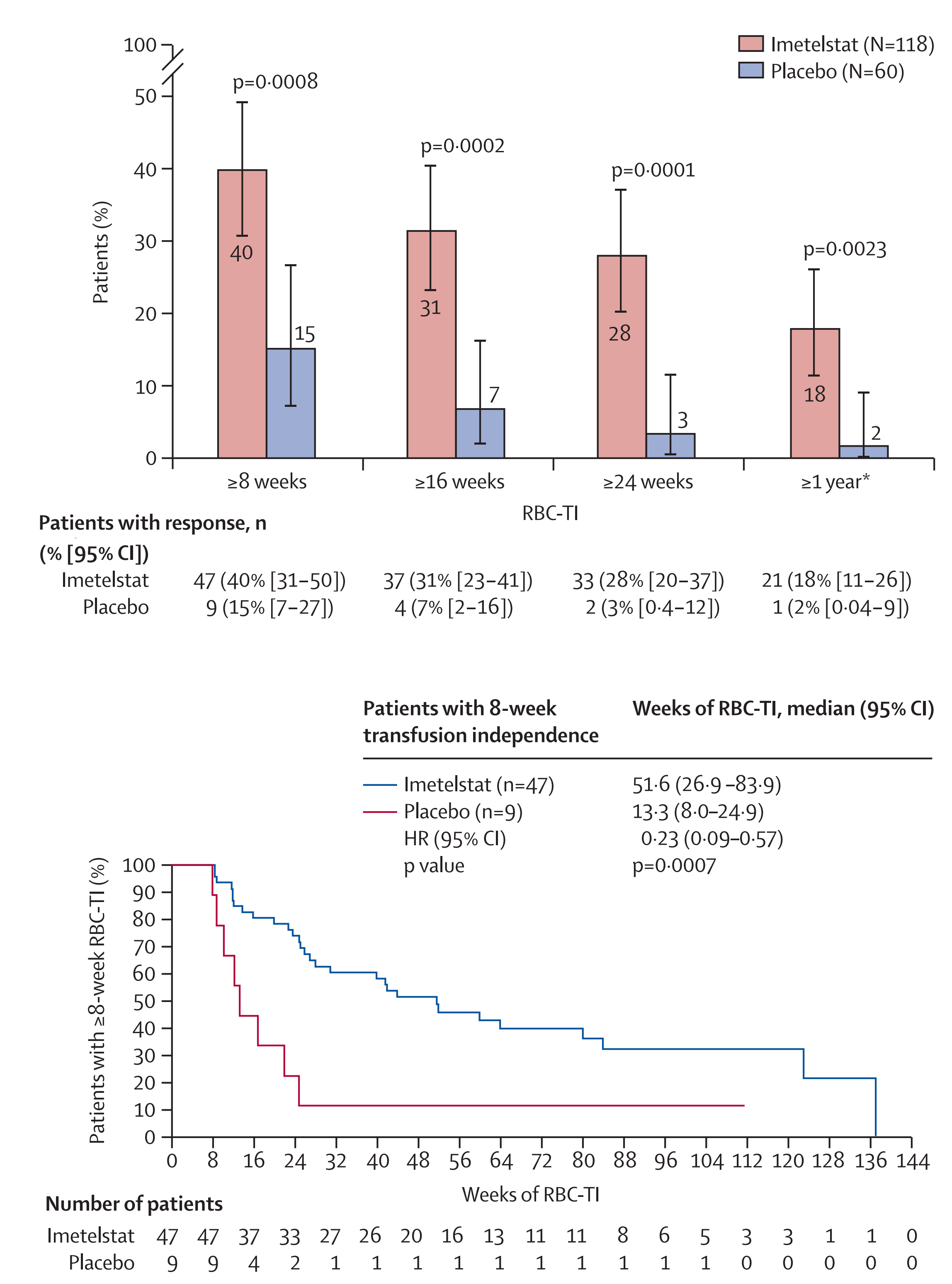
2024年6月6日,基于IMerge试验结果,FDA批准RYTELO™ (Imetelstat)用于治疗伴有输血依赖性贫血,需要 4 个或更多红细胞单位超过 8 周,且对红细胞生成刺激剂 (ESA) 无反应、失去反应或不符合使用条件的成人低至中度风险骨髓增生异常综合征(MDS)。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。


端粒酶抑制剂512
横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3