
Fostamatinib是选择性脾酪氨酸激酶(SYK)抑制剂类药物。为前体药物,在肠道黏膜碱性磷酸酶的作用下释放出R405发挥抗炎作用。
结构:
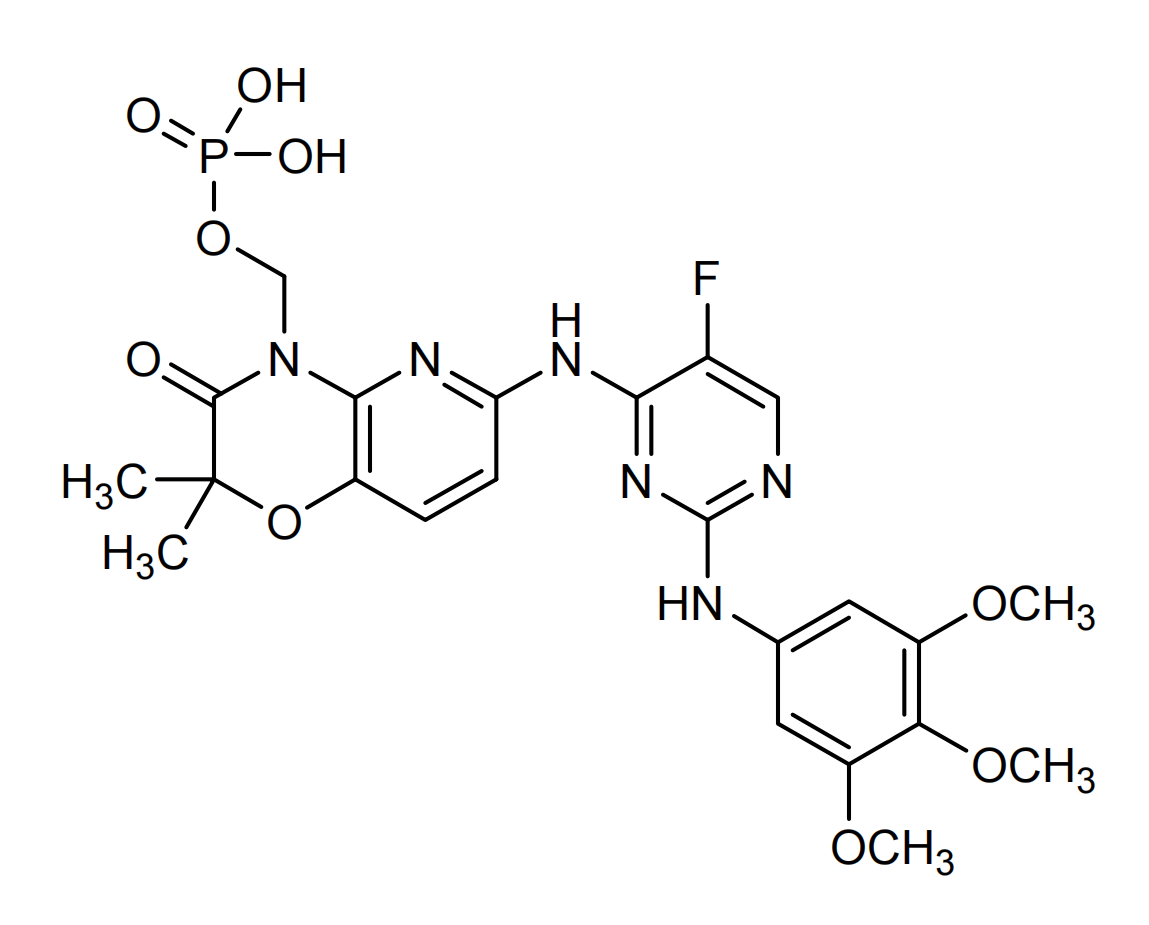
介绍:
Fostamatinib(研发代号R788,商品名Tavalisse)是Rigel Pharmaceuticals开发的口服小分子选择性脾酪氨酸激酶(SYK)抑制剂类药物。
脾酪氨酸激酶(SYK)存在于多种免疫细胞,在免疫受体信号转导中起着重要作用。配体作用于B细胞抗原受体(BCR)、T细胞抗原受体(TCR) 或Fc受体(FcR)后,会导细胞内免疫受体酪氨酸活化基序(ITAM)发生磷酸化。ITAM磷酸化会募集并激活SYK,从而进一步激活下游信号通路,引发多种免疫反应。
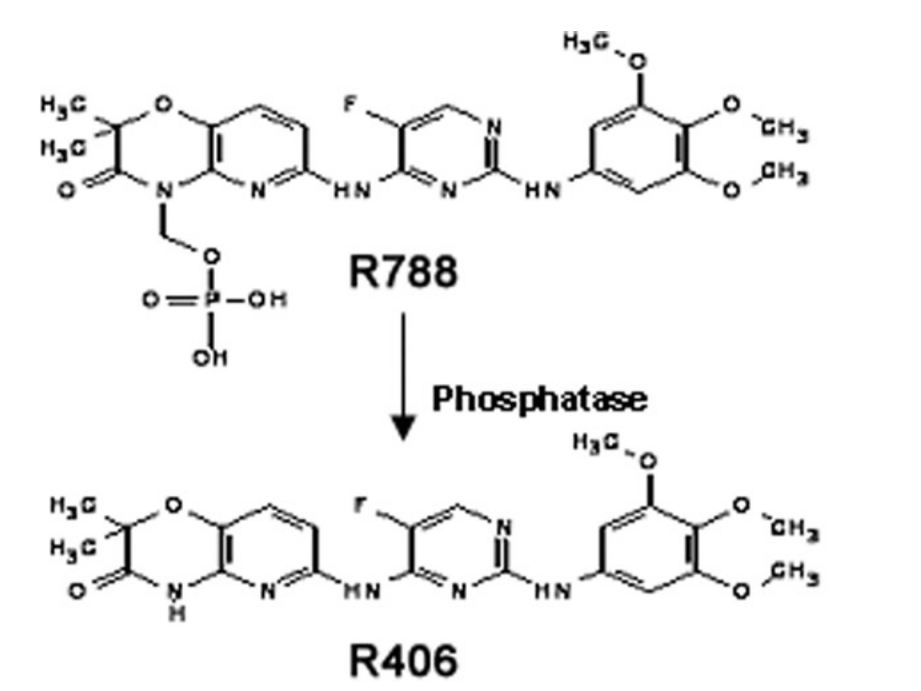
R788是R406的前体药物,在肠道黏膜碱性磷酸酶的作用下释放出R405发挥作用。
体外实验显示R406对于实验诱导肥大细胞脱粒具有显著的抑制作用(Sylvia Braselmann., 2006)。
2008年,Michael E Weinblatt等人发表SYK选择性抑制剂Fostamatinib(研发代号R788)治疗类风湿性关节炎2期临床试验结果。共纳入189名接受3个月甲氨蝶呤治疗仍未能缓解的受试者,随机接受一天两次Fostamatinib 50mg、100mg、150 mg或安慰剂治疗。至第12周Fostamatinib 100mg、150 mg剂量组符合美国风湿病协会(ACR)活动期类风湿关节炎缓解达到20%标准(ACR20)的比例分别为65% 和72%显著高于安慰剂组(38%)和Fostamatinib 50mg剂量组(32%)。Fostamatinib 100mg、150 mg剂量组达到ACR70的比例分别为33%和40%,安慰剂组和Fostamatinib 50mg剂量组分别为4%和2%,在试验期间主要的不良事件是胃肠道副作用(腹泻)和中性粒细胞减少(Michael E Weinblatt., 2008)。
2009年,Anna Podolanczu等人发表Fostamatinib治疗免疫性血小板减少性紫癜的2期临床试验结果。16名男性受试者中8例患者实现95%次随访血小板计数超过50×109/L(50 000 mm3)(Anna Podolanczu., 2009)。
2010年,阿斯利康AstraZeneca与Rigel Pharmaceuticals签订协议获得Fostamatinib的全球开发权利(AstraZeneca., 2010)。
2013年,阿斯利康发布了Fostamatinib治疗类风湿性关节炎3期临床试验OSKIRA-1的试验结果。该试验共纳入923对甲氨蝶呤(MTX) 治疗反应不佳的患者,随机接受Fostamatinib 100mg(一天两次)、Fostamatinib 150mg(100mg一天两次,4周后改为150mg一天一次)或安慰剂治疗。至第24 周Fostamatinib 100mg、150mg剂量组达到ACR20的比例分别为49%(p<0.001)和44%(p=0.006)显著优于安慰剂组(34%)。在试验期间,最常见不良事件包括高血压、腹泻、恶心、头痛和鼻咽炎(普通感冒)(AstraZeneca., 2013)。
同年阿斯利康发布了Fostamatinib治疗类风湿性关节炎3期临床试验OSKIRA-2和OSKIRA-3的试验结果。OSKIRA-2纳入对改善病情抗风湿药物(DMARD)治疗效果不佳的类风湿性关节炎患者,在DMARD基础上使用Fostamatinib 100mg(一天两次)、Fostamatinib 150mg(100mg一天两次,4周后改为150mg一天一次)或安慰剂进行治疗。至第24 周,Fostamatinib组达到ACR20的比例分别为39.6%(p<0.001),显著高于安慰剂组34%。OSKIRA-3 纳入对甲氨蝶呤 联合TNF-α 抑制剂治疗效果不佳的类风湿性关节炎患者,,在甲氨蝶呤基础上使用Fostamatinib 100mg(一天两次)、Fostamatinib 150mg(100mg一天两次,4周后改为150mg一天一次)或安慰剂进行治疗。至第24 周,Fostamatinib 100mg剂量组达到ACR20的比例分别为36.2%(p=0.004),显著高于安慰剂组21.1%。而150mg剂量组达到ACR20的比例分别为27.8%(p=0.168),未达到显著差异。由于Fostamatinib在OSKIRA-2和OSKIRA-3总体有效率不高,阿斯利康选择中止开发Fostamatinib(AstraZeneca., 2013)。
2018年,James Bussel等人发表Fostamatinib治疗免疫性血小板减少症的3期临床试验FIT1和FIT2的试验结果。患者按2:1的比例随机接受Fostamatinib(n = 101) 或安慰剂组 (n = 49)持续 治疗24 周。Fostamatinib剂量为100 mg BID, 4 周后无反应者剂量增加至 150 mg BID。至24 周,在14-24周,6次双周随访中血小板计数(≥50 000/μL)≥4次的比例,Fostamatinib组为18%,安慰剂组为2% (P = .0003)。在治疗的前12周,1次及以上血小板计数≥50 000/μL 的比例分别为43%和14%(P=.0006)。Fostamatinib组中位数应达时间是15天, 83%患者在8周内实际应达。在治疗期间常见的不良事件,包括腹泻(Fostamatinib组31%,安慰剂组15%)、高血压(28% vs 13%)、恶心(19% vs 8%)、头晕(11% vs 8%)和ALT增加(11% vs 0%)(James Bussel., 2018)。
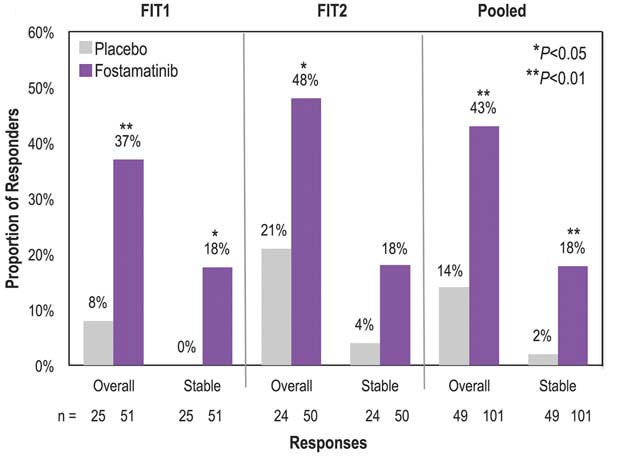
2018年4月17,基于上述研究结果FDA批准Fostamatinib(商品名Tavalisse)用于治疗慢性免疫性血小板减少症。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3