
伊马替尼是第1个被FDA批准的BCR-ABL1抑制剂,也能够抑制ABL、PDGFRA 和 c-KIT。已被FDA批准用于慢性粒细胞白血病、费城染色体阳性的急性淋巴细胞白血病和胃肠间质瘤。
结构:
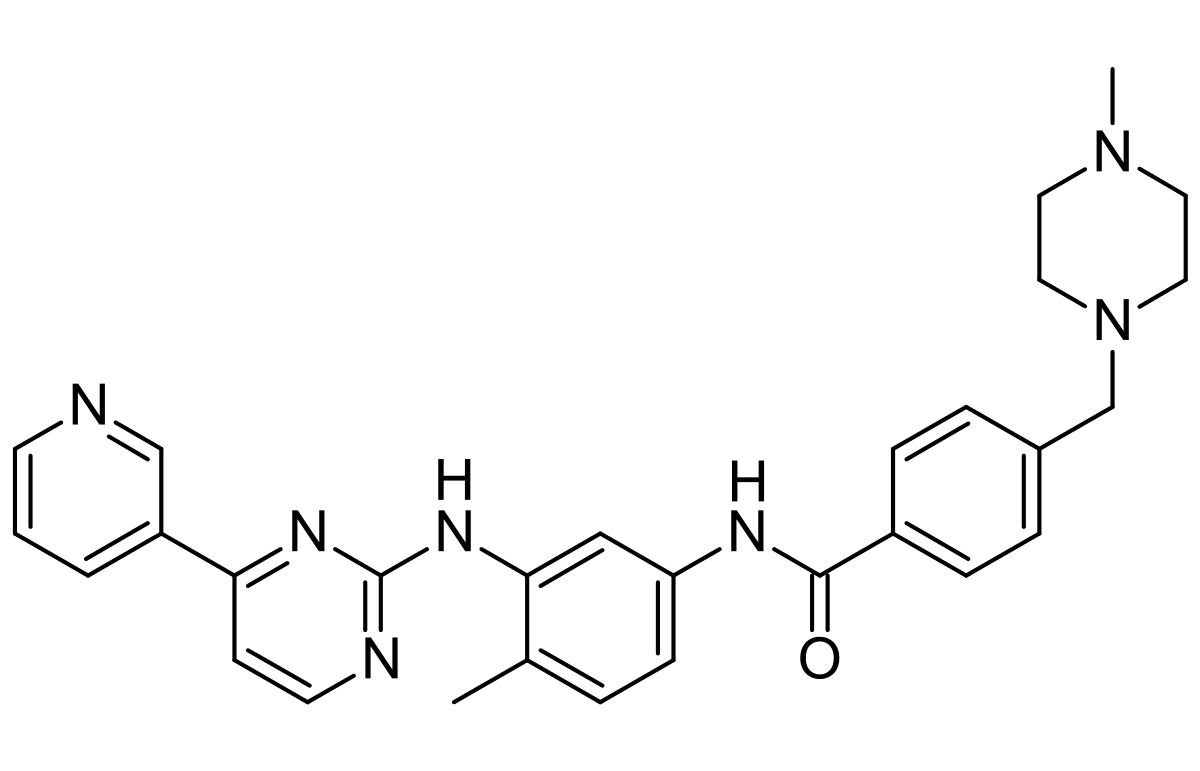
介绍:
伊马替尼Imatinib(Glivec格列卫)是诺华Novartis开发的BCR-ABL1抑制剂。
慢性粒细胞白血病表现为 9号染色体ABL1基因和22号染色体BCR基因易位融合发生达融合蛋白BCR-ABL1。BCR-ABL1会形成寡聚物,从而使BCR-ABL1持续激活。
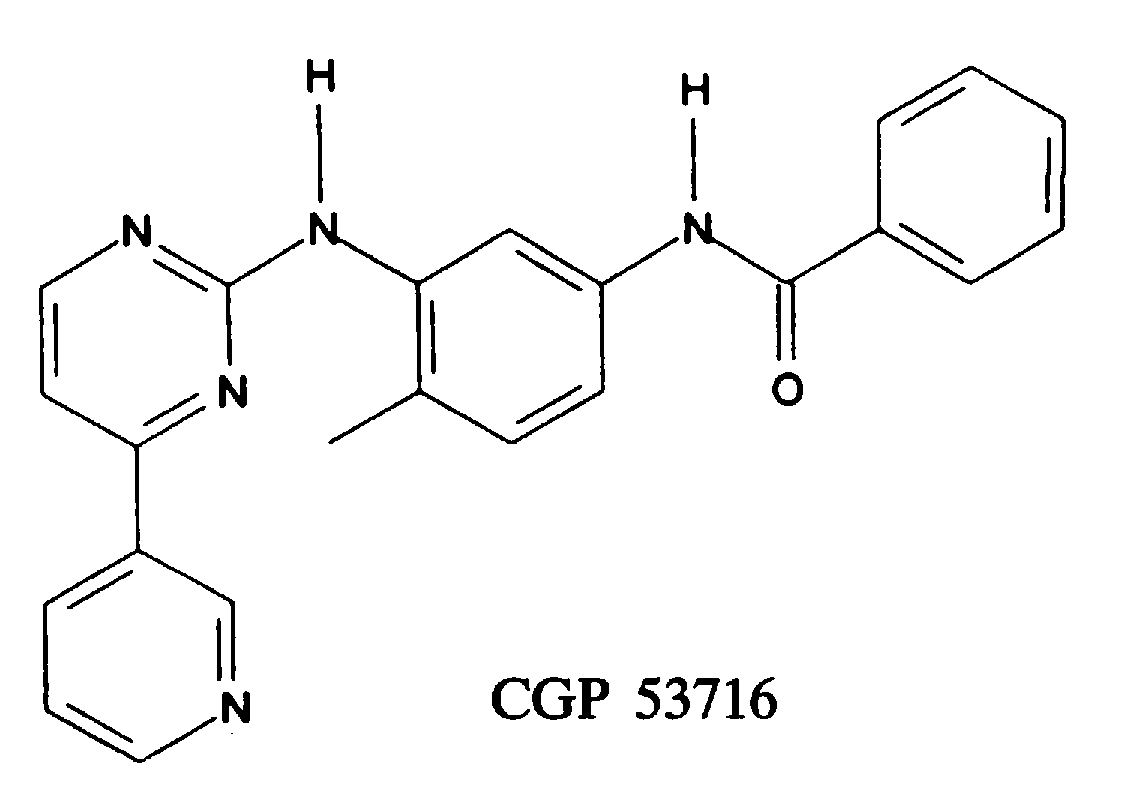
1995年,E Buchdunger等人报道筛选出能够抑制血小板源性生长因子(PDGF)受体的酪氨酸激酶抑制 CGP 53716(E Buchdunger., 1995)。
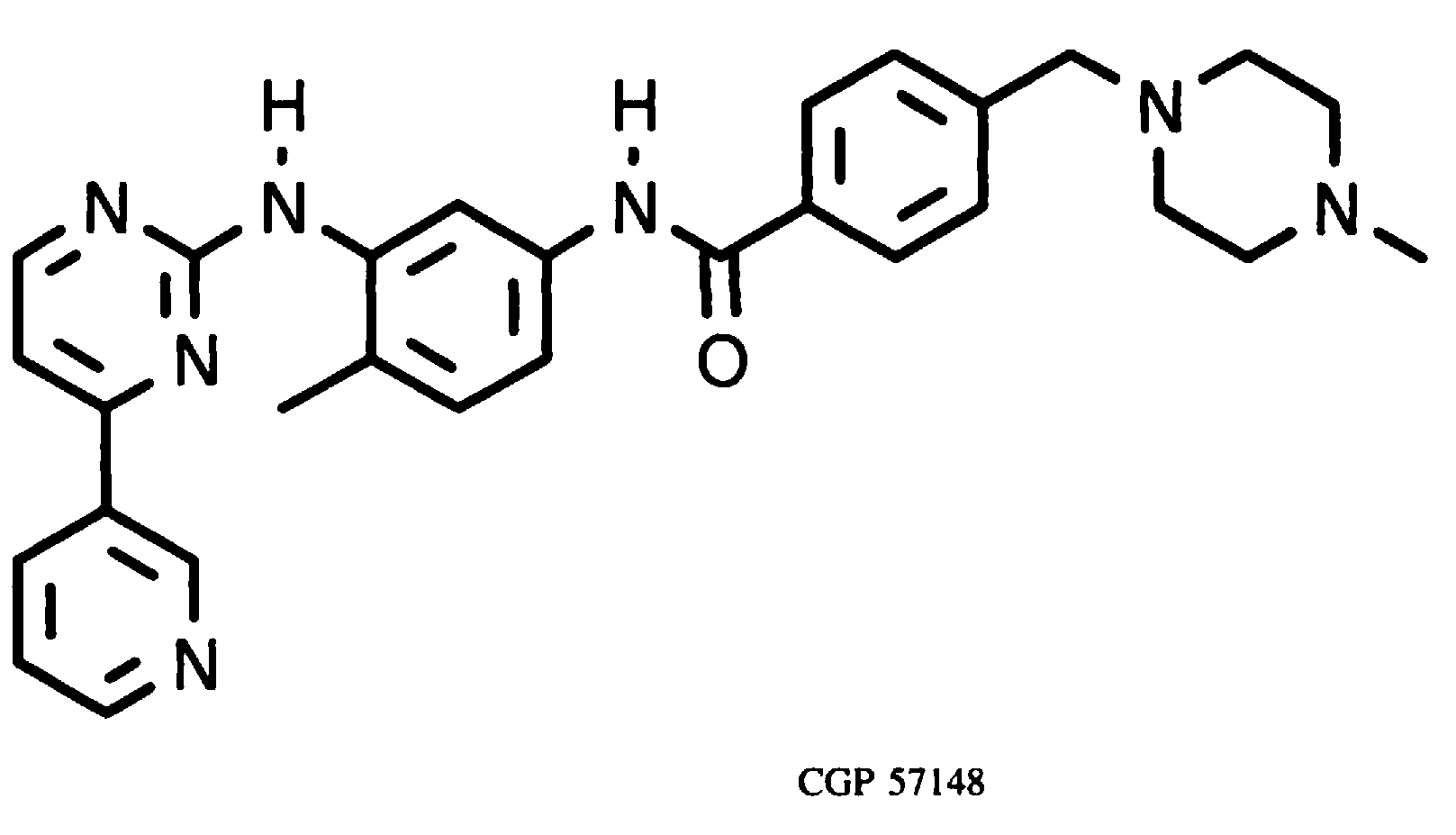
1996年,E Buchdunger等人报道筛选出能够抑制ABL酪氨酸激酶的CGP 53716结构类似物CGP 57148(伊马替尼Imatinib)(E Buchdunger,1996)。
同年,B J Druker等人研究显示CGP 57148能够显著抑制BCR-ABL阳性细胞增殖(B J Druker., 1996)。
之后CGP 57148被开发成甲磺酸盐制剂,研发编号改为STI571。
2001年,B J Druker等人发表STI571(伊马替尼)治疗干扰素α治疗失败的慢性粒细胞白血病(CML)1期临床试验结果。共纳入83例,分别接受25至1000 mg伊马替尼进行治疗。在接受每日剂量为300mg或以上的54例患者中,有53例获得完全血液学反应,完全血液学反应通常发生在治疗的前四周。此外,在接受每日剂量300mg或以上的54例患者中,有29例获得细胞遗传反应,其中17例获得部分细胞遗传学反应(费城染色体阳性率1%-35%),7例获得完全细胞遗传学反应(费城染色体阳性率0%)。在试验期间伊马替尼发生的不良事件轻微,最常见的不良事件包括恶心、肌痛、水肿和腹泻(B J Druke,2001)。
2001年,基于3项伊马替尼(Imatinib)用于干扰素α治疗失败的慢性粒细胞白血病的单臂多中心研究,伊马替尼(Glivec格列卫)被FDA批准用于干扰素α治疗失败的慢性粒细胞白血病(CML)。
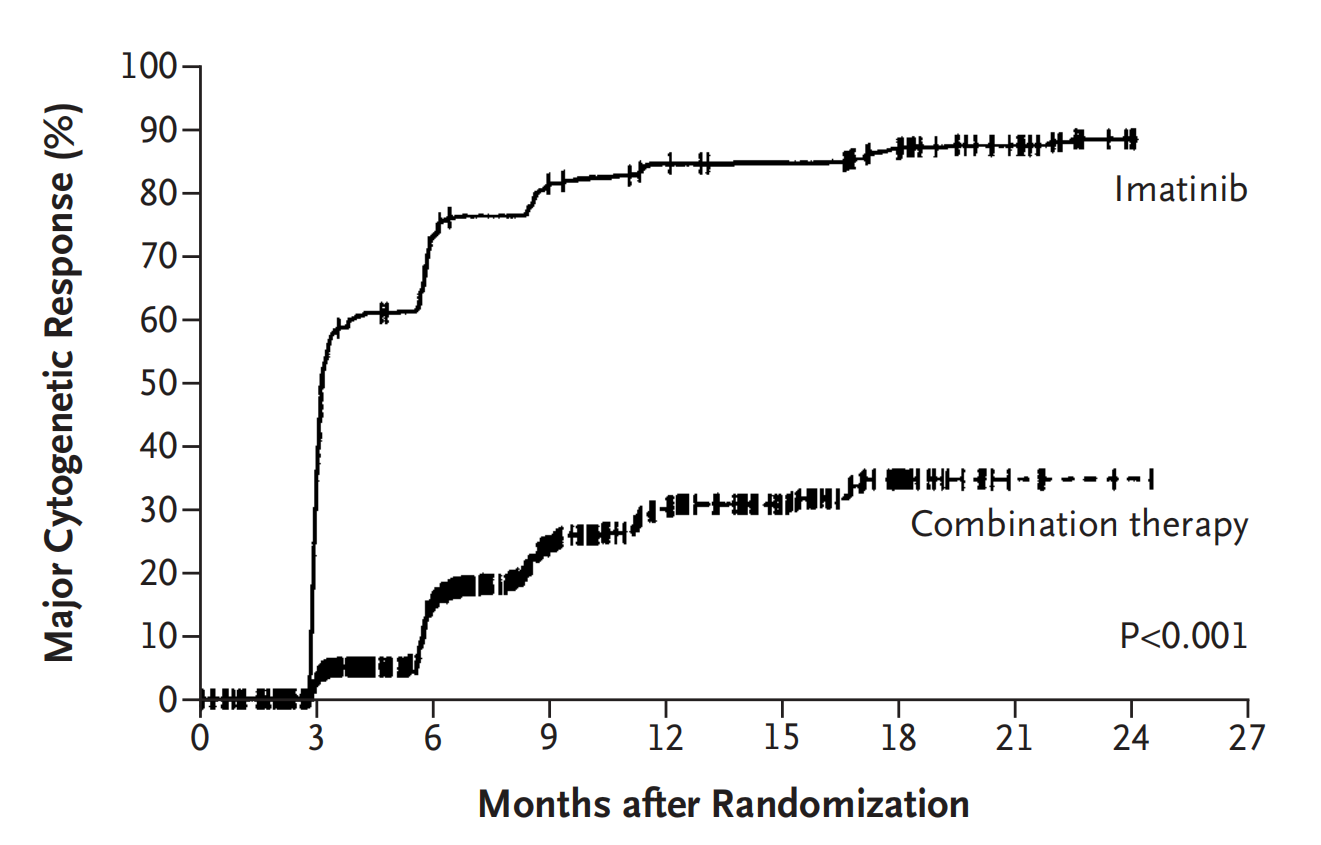
2003年,Stephen G O'Brien等人发表伊马替尼与干扰素联合低剂量阿糖胞苷相比治疗慢性粒细胞白血病头对头对比试验结果。该试验共纳入1106患者,治疗18个月。伊马替尼组细胞遗传学反应(费城染色体阳性率0%-35%)率为87.1%,干扰素联合低剂量阿糖胞苷组为34.7%(P<0.001)。细胞遗传学完全反应率分别为76.2%和14.5%(P<0.001)。到第18个月,伊马替尼组和联合用药组没有进入加速期或急变期的比例分为96.7%和91.5(P<0.001)。此外,伊马替尼的耐受性也好于联合用药组(Stephen G O'Brien., 2003)。
BCR-ABL1突变除了见于慢性粒细胞白血病之外,部分急性淋巴细胞白血病也可见BCR-ABL1突变。2013年,伊马替尼(Glivec格列卫)被FDA批准用于儿童费城染色体阳性的急性淋巴细胞白血病(ALL)。
伊马替尼除了能够BCR-ABL1之外,也能够抑制ABL、PDGFRA 和 c-KIT。胃肠间质瘤主要以c-KIT突变为主,部分为PDGFRA突变。2008年,伊马替尼(Glivec格列卫)被FDA批准用于胃肠间质瘤。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3