
他泽司他是EZH2抑制剂,通过抑制组蛋白H3第27位的赖氨酸残基发生甲基化,实现抑制肿瘤细胞的增殖。其对对突变型和野生型EZH2,都具有较强的活性。
结构:
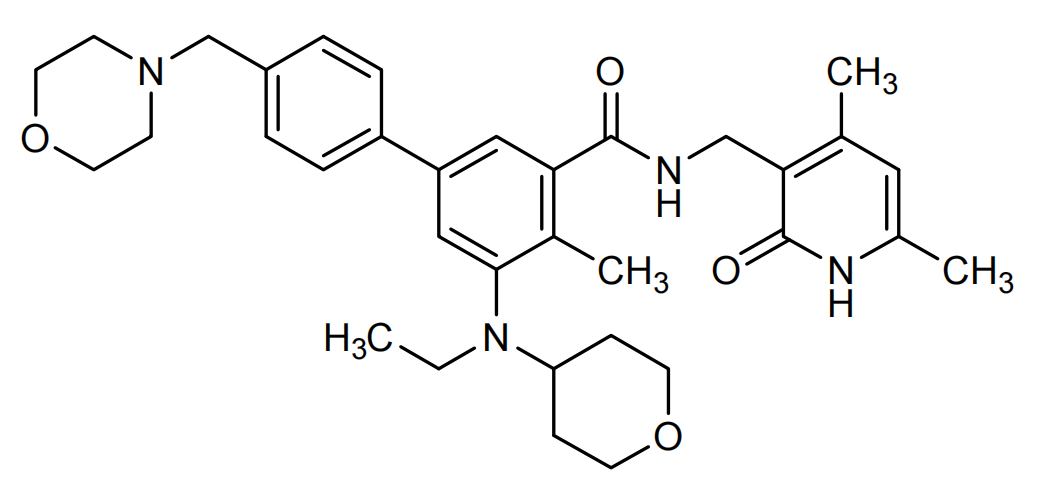
介绍:
他泽司他Tazemetostat(商品名Tazverik,研发代号EPZ-6438)由Epizyme开发,2022年益普生Ipsen收购Epizyme获得Tazemetostat。
Tazemetostat为EZH2抑制剂。EZH2为甲基转基酶,EZH2抑制剂通过抑制组蛋白H3第27位的赖氨酸残基发生甲基化,实现抑制肿瘤细胞的增殖。
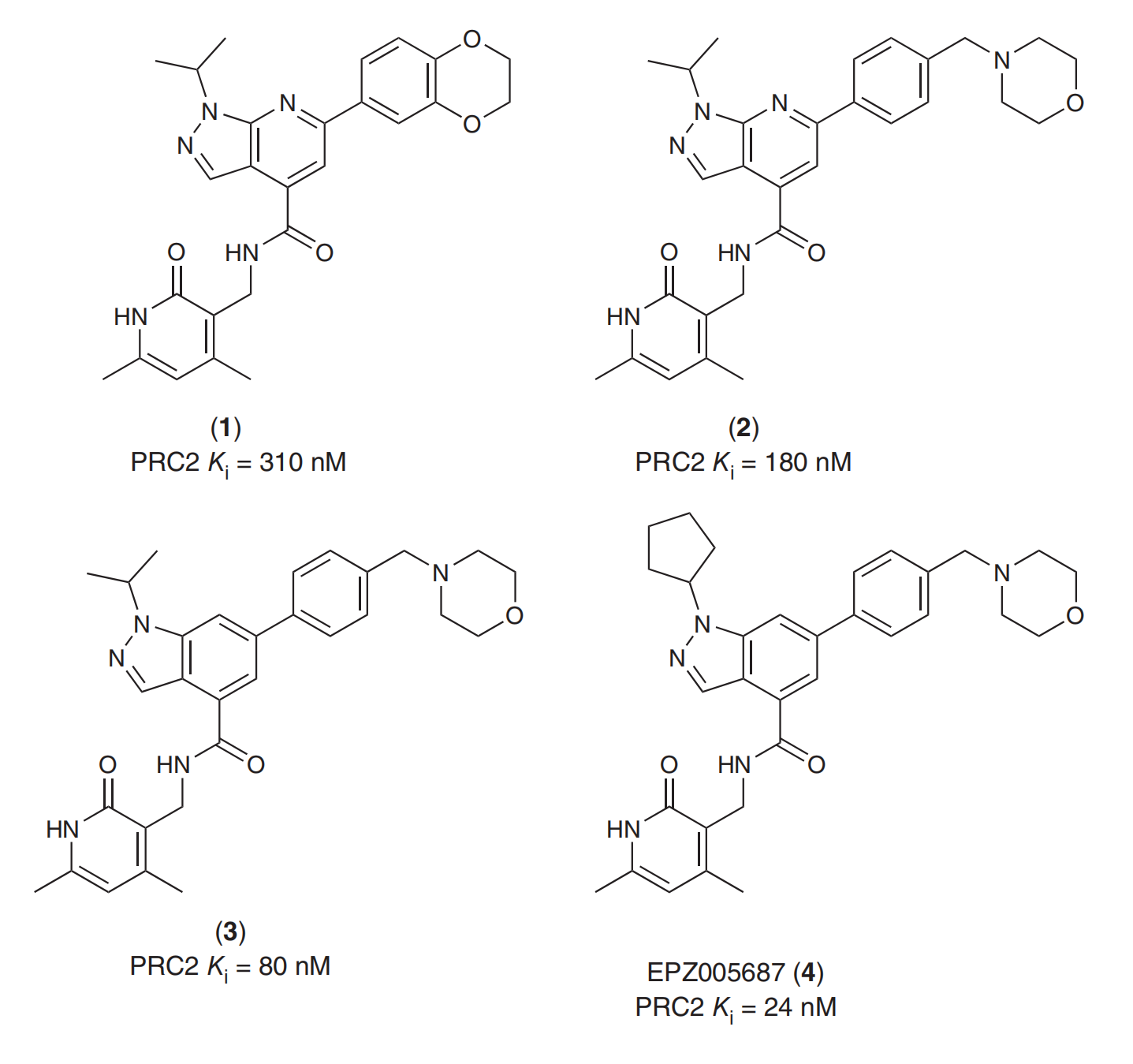
Tazemetostat是在高通量筛选基础上,进行优化得到含2-吡啶酮结构的苗头化产物,并进一步优化得到的EZH2抑制剂
在苗头化产物基础上筛选结构结构类物,得到化合物1。1的溶解性较差,生物利用度低,对1中的苯并二氧六环进行替换筛选得到2。2的溶解性得到改善,活性也得到增强。对2中间的咪唑并吡啶结构进行优化筛选得到3,活性进一步增强。对3苯并咪唑上的异两基进行筛选优化得到活性更强的4(EPZ005687)(Sarah K Knutson., 2012)。
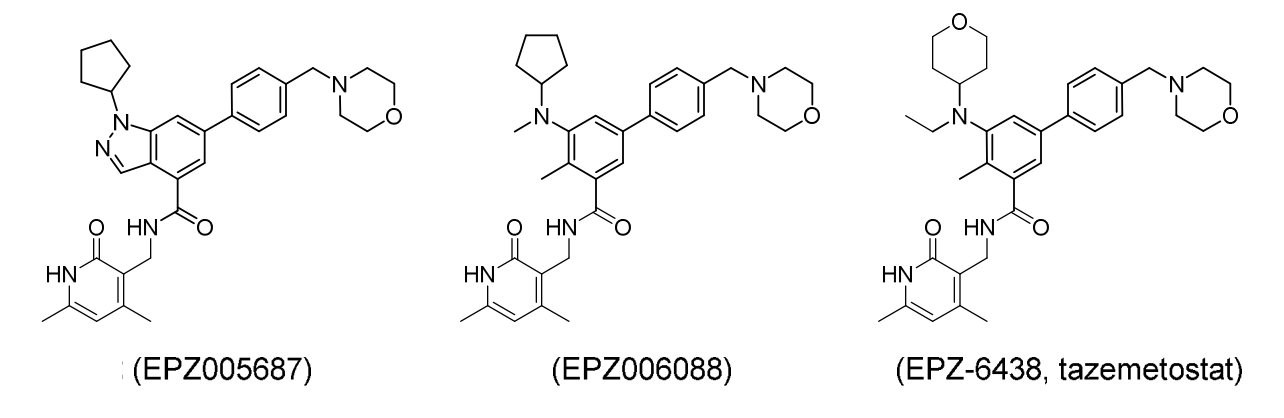
打开EPZ005687的咪唑环优化筛选得到活性更强EPZ006088,由于EPZ006088具有较高的亲脂性(cLogD),生物利用度较低。将N上的环戊烷替换也极性更强的四氢吡喃,并将N上的甲基替换成乙基得到Tazemetostat。Tazemetostat在活性、生物利用度、肝清除等方面都得到改善。
| ID# | ELISA EC50 (µM) | Cl (mL/min/kg) | AUC (hr*ng/mL) | Vss (L/kg) | %F | cLogD |
| EPZ005687 | 2.9±1 | 11 | 2900 | 0.49 | 47 | - |
| EPZ006088 | 0.7±0.2 | 16 | 2500 | 0.66 | 24 | 4.2 |
| Tazemetostat | 0.2±0.1 | 13 | 2500 | 1.0 | 55 | 3.2 |
Tazemetostat对突变型和野生型EZH2,都具有较强的活性(Rossella Fioravanti., 2018)。
| Catalytic Subunit | EPZ005687 IC50 (nM) |
| EZH2 WT | 54 ± 5 |
| EZH1 WT | 2,713 ± 1,062 |
| EZH2 Tyr641Phe | 76 ± 15 |
| EZH2 Tyr641Asn | 41 ± 9 |
| EZH2 Tyr641His | 35 ± 7 |
| EZH2 Tyr641Ser | 40 ± 19 |
| EZH2 Tyr641Cys | 123 ± 60 |
| EZH2 Ala677Gly | 10 ± 1 |
| Enzyme assay | Tazemetostat IC50 (nM) |
| EZH1 | 392 ± 72 |
| EZH2 peptide assay | 11 ± 5 |
| EZH2 nucleosome assay | 16 ± 12 |
| A677G EZH2 | 2 |
| A687V EZH2 | 2 |
| Y641F EZH2 | 14 ± 5 |
| Y641C EZH2 | 16 |
| Y641H EZH2 | 6 |
| Y641N EZH2 | 38 |
| Y641S EZH2 | 6 |
2014年,Sarah K Knutson等人的研究显示,Tazemetostat对小鼠EZH2 突变非霍奇金淋巴瘤,具有显著的抑制作用(Sarah K Knutson., 2014)。
2020年,Mrinal Gounder等人发表TazemetostatI治疗NI1/SMARCB1缺失晚期上皮样肉瘤的2期临床试验结果。该实验共纳入62 名上皮样肉瘤患者。在32周,有16例(26%[95%CI 16-39])患者时疾病得到控制。患者的中位缓解时间为3.9 个月(IQR 1.9-7.4)。中位无进展生存期为5.5个月(95%CI 3.4-5.9),中位总生存期为19.0个月(11.0-不可估计)。在治疗期间≥3 级治疗相关不良事件包括贫血(4 例 [6%])和体重减轻(2 例 [3%])。2例患者发生治疗相关严重不良事件(1例癫痫发作,1例咯血)。没有出现与治疗相关的死亡病例(Mrinal Gounder., 2020)。
同年,FDA批准Tazemetostat(商品名Tazverik)用于不符合完全切除条件16岁及以上儿童和成人转移性或局部晚期上皮样肉瘤。
2020年,Franck Morschhauser等人发表TazemetostatI治疗复发/难治性滤泡性淋巴瘤的2期临床试验结果。该实验共纳入99 名患者,其中包括45名EZH2突变型和54名EZH2野生型患者。EZH2突变型和野生型患者的客观缓解率分别为69%(95%CI 53-82)、 35%(23-49)。中位缓解持续时间为分别为10.9 个月(95% CI 7.2-不可估计)和13.0个月(5.6-不可估计),中位数无进展生存期分为13.8个月(10.7-22.0)和11.1个月(3.7-14.6)。在治疗期间≥3 级不良事件包括血小板减少症(3 例 [3%])、中性粒细胞减少症(3 例 [3%])和贫血(2 例 [2%]),4 例(4%)患者 报告了严重的治疗相关不良事件。没有与治疗相关的死亡(Franck Morschhauser., 2020)。
同年,FDA批准Tazemetostat(商品名Tazverik)用于治疗复发/难治性滤泡性淋巴瘤。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3