
Selinexor是首个被批准的XPO1抑制剂,通过阻止核蛋白经由XPO1运出细胞核,发挥抗肿瘤作用。
结构:
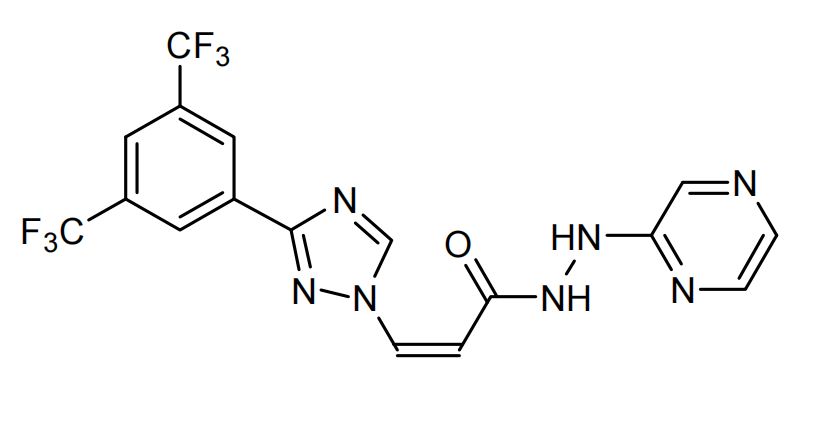
介绍:
塞利尼索Selinexor(商品名希维奥Xpovio,研发代号KPT-330)由Karyopharm Therapeutics开发,是在高通量筛选的基础上,经过优化得到XPO1抑制剂。尽管与KPT-185相对有所下降,但生物利用度得到显著提高(Julia Etchin., 2013)。
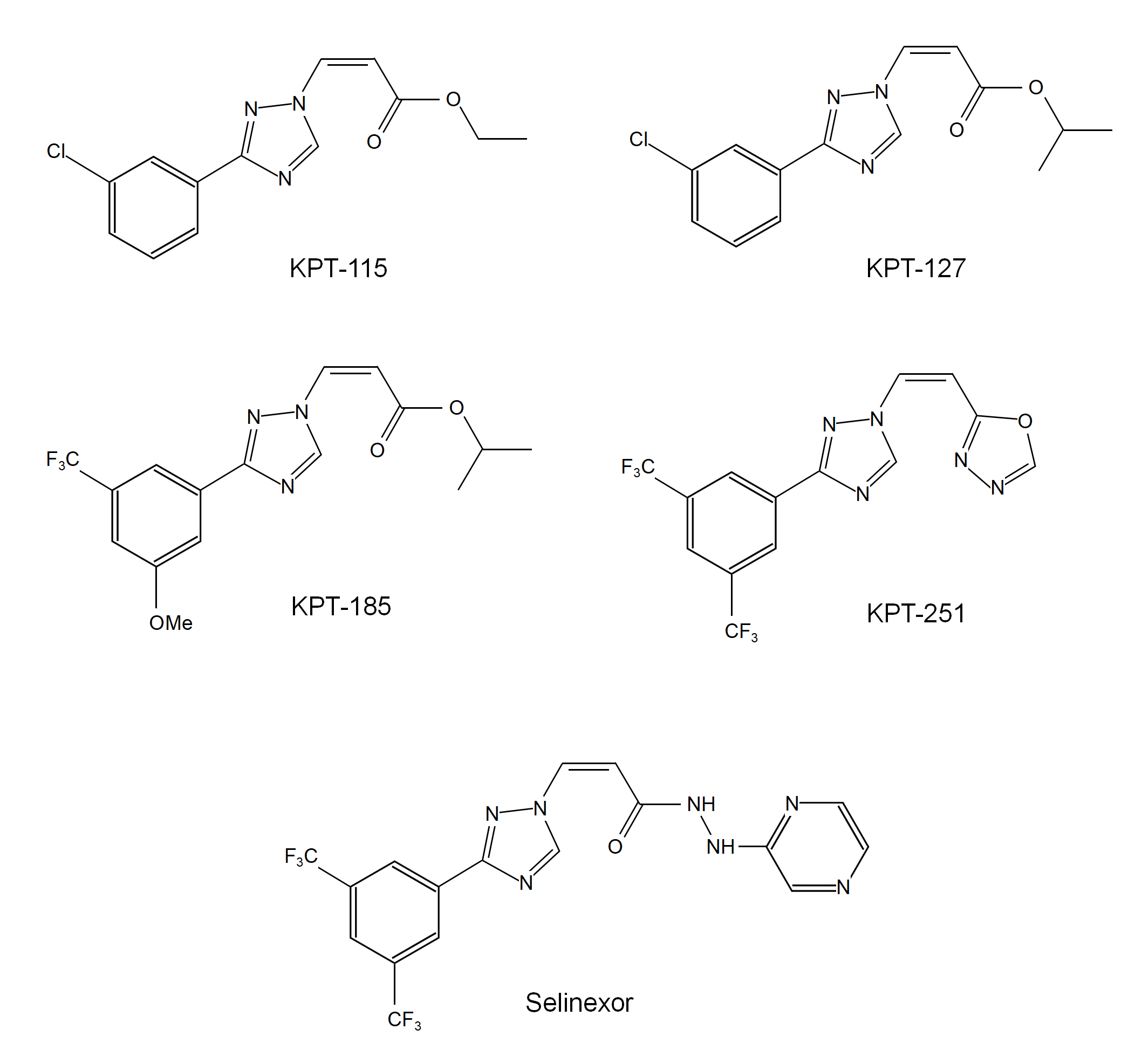
XPO1抑制剂能够通过阻止核蛋白经由XPO1运出细胞核,发挥抗肿瘤作用。
2013年Jasper E Neggers等人的研究显示,XPO1 C528S基因突变对于Selinexor具有耐受性,说明Selinexor与其它的XPO1抑制剂相类似,通过作用于XPO1第528位的半胱氨酸发挥作用(Jasper E Neggers., 2013)。
2019年,Ajai Chari等人发表Selinexor联合地塞米松治疗三重耐药难治性多发性骨髓瘤2b期临床试验的试验结果。该试验共纳入123例至少对一种蛋白酶体抑制剂、一种免疫调节剂和达雷妥尤单抗耐药的患者。试验结果显示,26%的患者实现部分缓解(血清骨髓瘤蛋白水平下降≥50%),其中2例实现完全缓解。39%的患者达到或超过初步缓解(血清骨髓瘤蛋白水平下降≥25 至<50%)。患者中位数持续反应时间为4.4个月,中位数无进展生存期为3.7个月,中位数总生存期为8.6个月。在治疗期间常见的不良事件是疲劳、恶心和食欲下降。通常为1级或2级,25%的患者达到3级事件,没有4级事件报告。73%的患者出现血小板减少(其中3级不良事件占25%,4级占33%)。6例患者因血小板减少而导致出现3级或以上的出血事件(Ajai Chari., 2019)。
2019年,FDA批准Selinexor(商品名Xpovio)与地塞米松联用治疗至少既往至少对四种药物耐药(包括至少对2蛋白酶体抑制剂耐药,至少对两种免疫调节剂耐药,至少对一种抗 CD38单克隆抗体耐药)的复发或难治性多发性成人骨髓瘤(RRMM)。2020年,FDA批准Selinexor用于治疗复发或难治性弥漫性大B细胞淋巴瘤。同年,FDA批准Selinexor与硼替佐米和地塞米松联用,用于治疗既往至少对一种药物耐药的复发或难治性多发性成人骨髓瘤(RRMM)。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3