
Izokibep属于使用Affibody技术的低分子量蛋白质IL-17A配体陷阱。含有3个结构域,均来自于葡萄球菌蛋白A的Z结构域。中间的Z结构域能够识别白蛋白,从而延长在体内的作用时间,两边的Z结构域能够识别IL-17A,与中间的Z结构共同构成配体陷阱。阻止IL-17A作用于受体引起炎症反应。
结构:
|
|
AEAKYAKEAD | DAAVEIASLP | NLTWDQWYAF | IQKLRDDPSQ | SSELLSEAKK | 50 |
|
|
LNDSQAPKAS | GSLAEAKEAA | NAELDSYGVS | DFYKRLIDKA | KTVEGVEALK | 100 |
|
|
DAILAALPGT | GGGGSAEAKY | AKEADDAAVE | IASLPNLTWD | QWYAFIQKLR | 150 |
|
|
DDPSQSSELL | SEAKKLNDSQ | APK |
|
|
200 |
介绍:
Izokibep(研发代号:ABY-035)是ACELYRIN开发的IL-17A抑制剂,属于使用Affibody技术的低分子量蛋白质IL-17A配体陷阱。
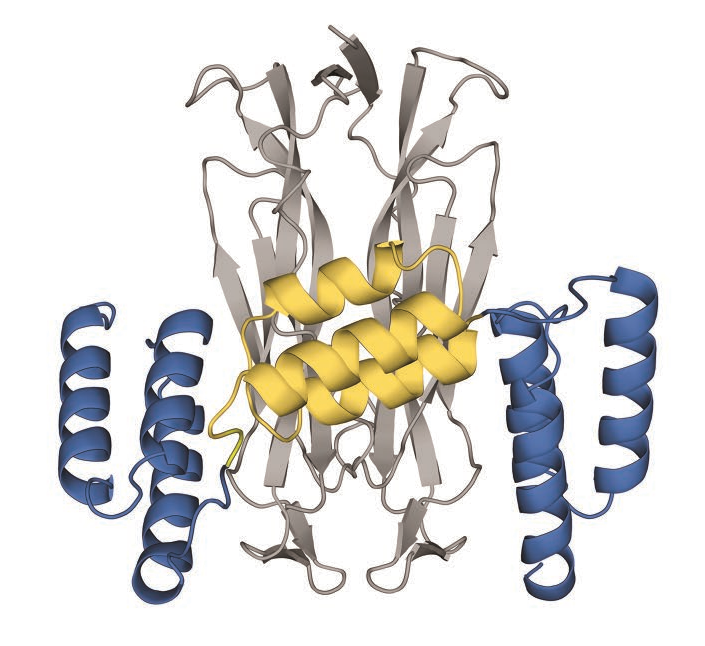
Izokibep含有3个结构域,均来自于葡萄球菌蛋白A的Z结构域。
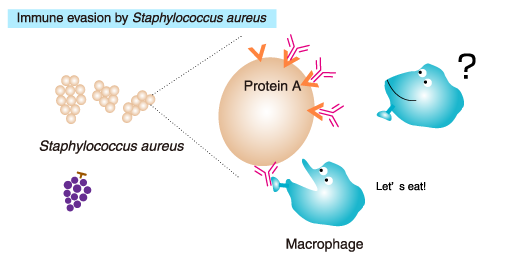
1966年,A Forsgren和J Sjöquist发现葡萄球菌蛋白A(Staphylococcal Protein A)与IgG抗体之间的反应不是真正的抗原-抗体反应(A Forsgren., 1966)。葡萄球菌蛋白能A够被IgG的Fc段识别,从而导致免疫逃逸。
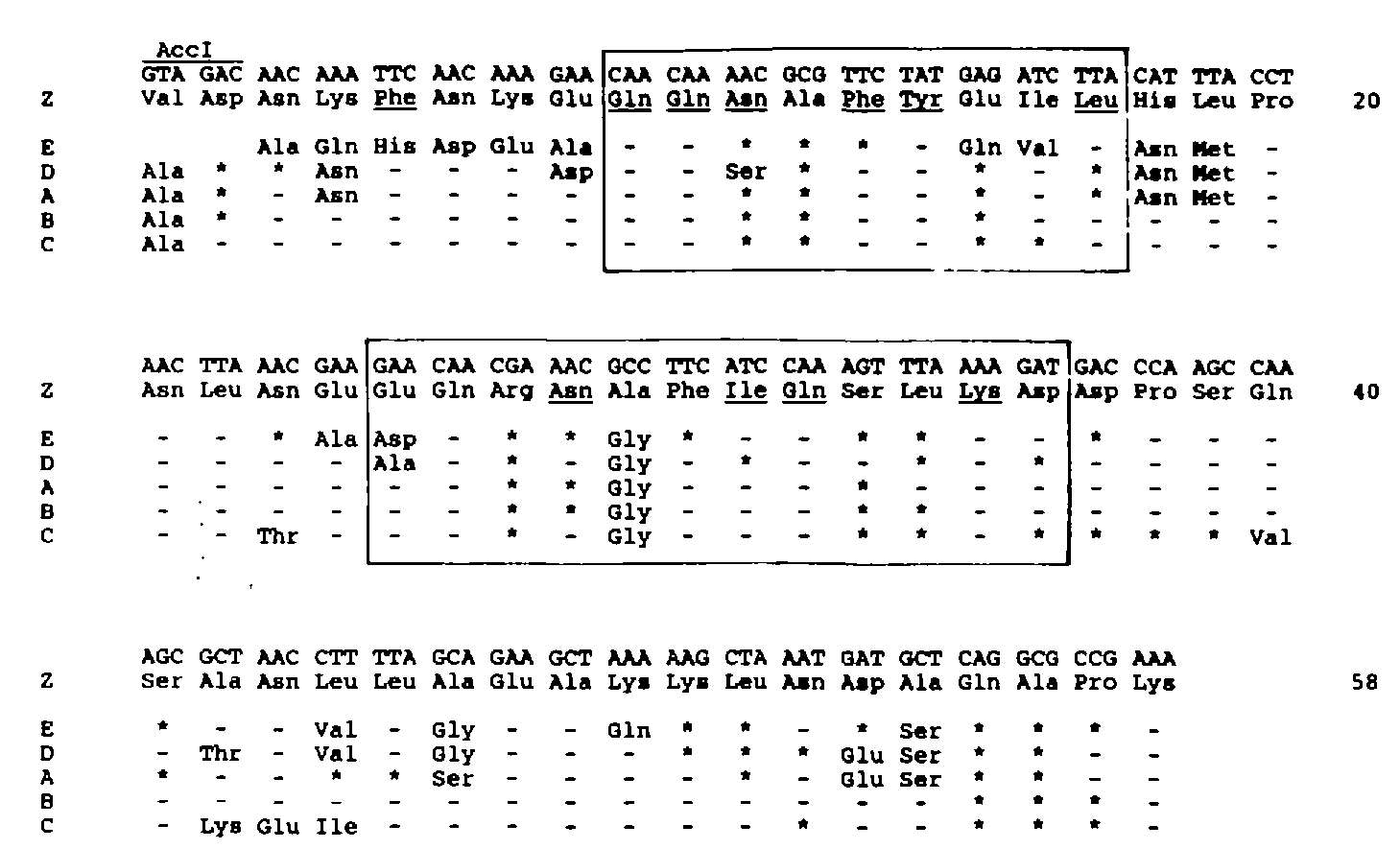
1984年M Uhlén等人确定了葡萄球菌蛋白A的完整序列,其中包括5个同源能够被IgG段 Fc段识别含约 58个氨基酸残基的结构区域(A-E)(M Uhlén., 1984)。
1987年,B Nilsson等人为了提高对于胰蛋白酶、羟胺及溴化氰的稳定性,在葡萄球菌蛋白A B结构域的基础上将C端丙氨酸(Ala)替换成缬氨酸(Val)残基,并将第28-29的天门冬酰胺(Asn)-甘氨酸(Gly)替换成天门冬酰胺(Asn)-丙氨酸(Ala)残基,命名为葡萄球菌蛋白A Z结构域(B Nilsson., 1987)。由于葡萄球菌蛋白A Z结构域具有良好的稳定性,之后被广泛用于重组蛋白的纯化。
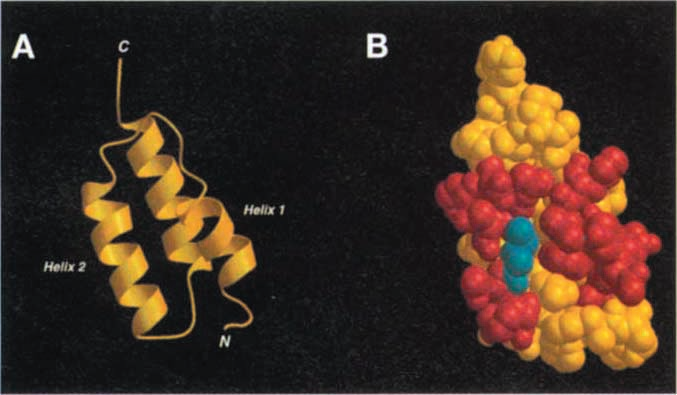
Z结构域含有3个α螺旋,共13个氨基酸用于识别Fc段。通过随机替换这个13个氨基酸,1997年K Nord等人建立能够于特异性识别目标蛋白质的分子库Affibody(K Nord., 1997)
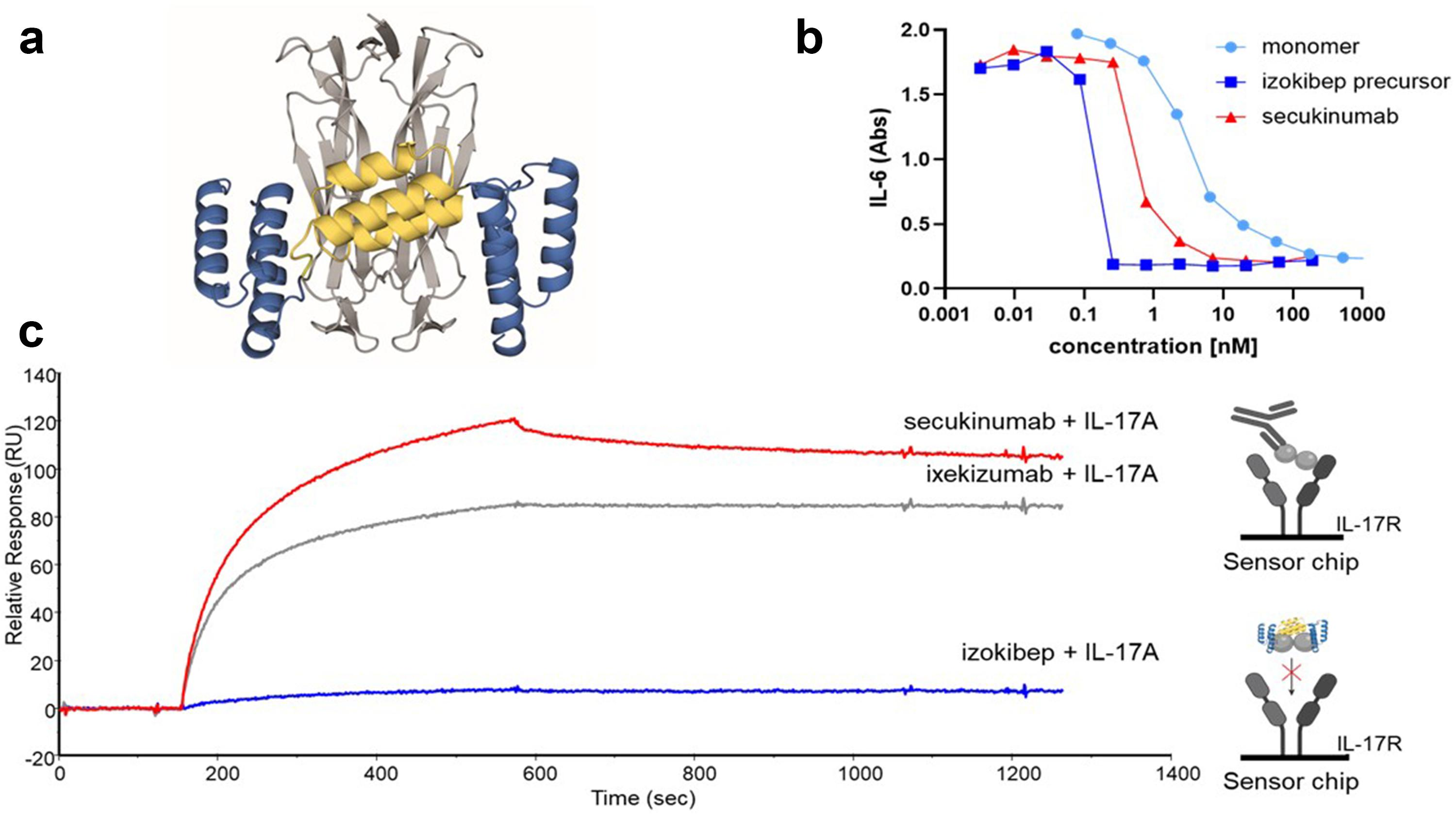
Izokibep中间的Z结构域能够识别白蛋白,从而延长在体内的作用时间,两边的Z结构域能够识别IL-17A,与中间的Z结构共同构成配体陷阱。阻止IL-17A作用于受体引起炎症反应.体外试验显示Izokibep抑制IL-17A的作用强于IL-17A单克隆抗体司库奇尤单抗(Secukinumab)和依奇珠单抗(Ixekizumab)(Susanne Klint., 2023)。
2023年,Sascha Gerdes等人发表Izokibep治疗中重度斑块状银屑病的2其临床试验研究结果。共纳入109 名患者按1:1:1:1随机接受Izokibep 2、20、80或160 mg,每 2 周一次,或安慰剂治疗12周。接续进行在为期40周的核心研究,在核心研究阶段根据《银屑病面积和严重程度指数 (PASI)》评分调整给药间隔,在此阶段安慰剂组改用Izokibep 80mg。核心研究阶段之后是2个1年的可选拓展研究期,试验全程共3年。在第 12 周,安慰剂组、Izokibep 2mg、20mg、80mg和160mg组达到PASI 90(PASI的改善程度达到90%)的比例分别为 0%、5%、19%、71% 和 59%。在安慰剂对照期阶段,Izokibep组除轻微的注射部位反应之外,不良事件发生情况与安慰剂相似。试验显示Izokibep耐受性良好,不良事件通常是轻至中度。Izokibep较高剂量组3年治疗一直保持疗效,没有出现新的安全性信号(Sascha Gerdes., 2023)。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3