
Lebrikizumab为IgG4人源化抗IL-13的克隆抗体,通过与IL-13结合, 阻止IL-13作用于Ⅱ型IL-4R发挥作用。
结构:

介绍:
Lebrikizumab原是由罗氏Roche旗下基因泰克Genentech开发的IgG4人源化抗IL-13克隆抗体。
Lebrikizumab原作为抗哮喘药物开发,但在两项3期临床试验中,LAVOLTA Ⅰ研究达到主要终点,LAVOLTA Ⅱ研究未能达到主要终点(Nicola A Hanania., 2016)
2017年,Dermira 从罗氏及基因泰克获得Lebrikizumab除间质性肺病之外的独家开发权利(Genengnews., 2017)
2020年,礼来Eli Lilly收购Dermira,将Lebrikizumab纳入旗下(Eli Lilly., 2020)。
Lebrikizumab通过与IL-13结合, 阻止IL-13与Ⅱ型IL-4R的IL- 4Rα的结合发挥作用(Mark Ultsch., 2013)。与Tralokinumab和Cendakimab相比,Lebrikizumab与IL-13的亲和力强且解离速度慢(Angela J Okragly., 2023)。
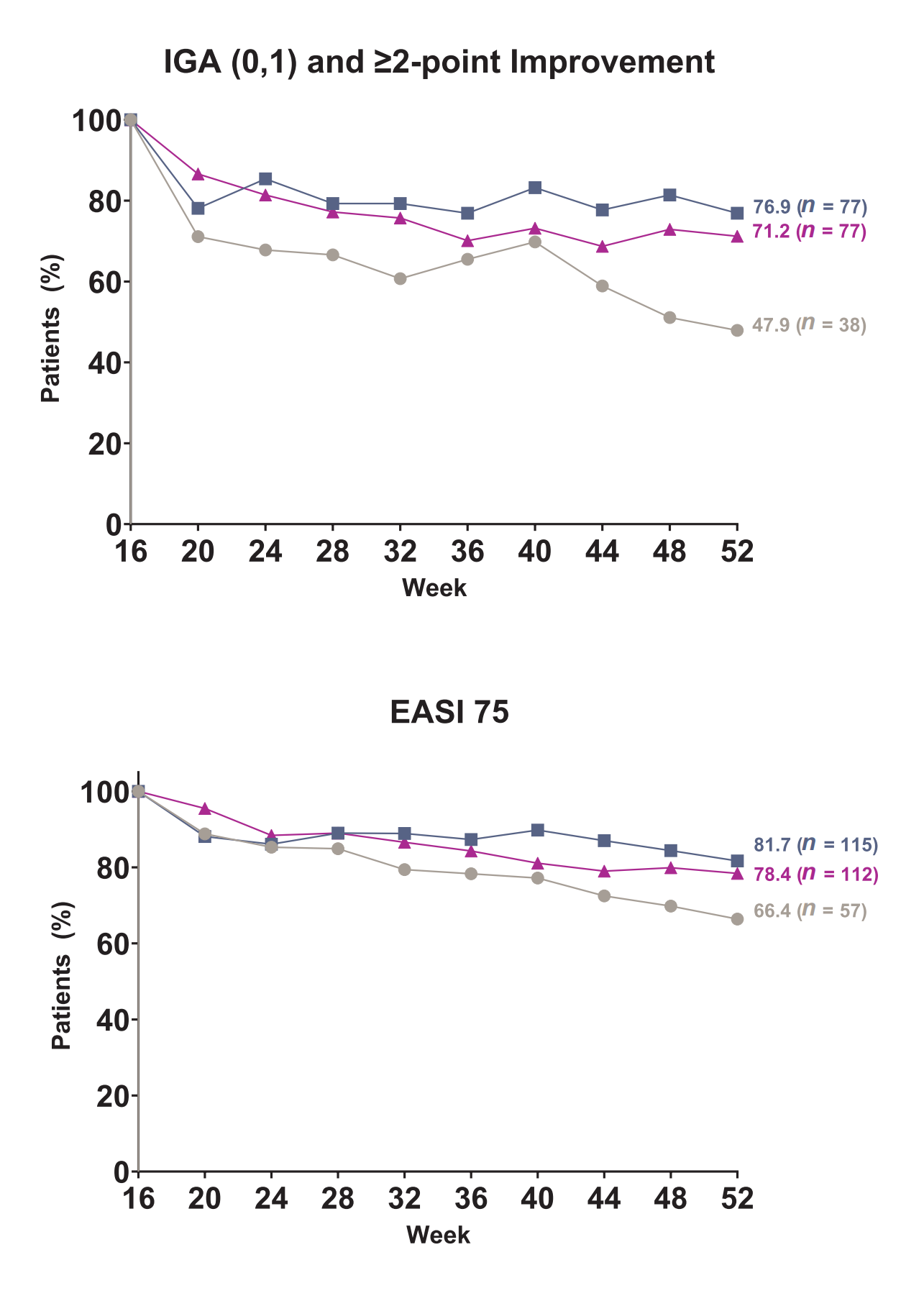
2024年,Andrew Blauvelt等人发表Lebrikizumab治疗中重度特应性皮炎3期临床试验 ADvocate1和ADvocate2研究结果。入组患者在接受16周Lebrikizumab诱导期治疗后, 湿疹面积和严重指数程度(EASI )改善达到75%,或研究者整体评估量表(IGA)评分为为0-1分,IGA改善≥2分,且未使用援助药物的患者(ADvocate1中55%的患者、ADvocate2中47.7%的患者) 按2 : 2 : 1比例随机接受 Lebrikizumab 250 g Q2W、Lebrikizumab 250 g Q4W或安慰剂Q2W 继续治疗直至第52周。至第52周, Lebrikizumab Q2W组中71.2%的患者、Q4W组中76.9%的患者、 Lebrikizumab停药组中47.9% 的患者IGA评分维持在0-1分,且与基线相比IGA改善≥2分。 Lebrikizumab Q2W组中78.4%的患者、、Q4W组中781.7%的患者、 Lebrikizumab停药组中66.4%的患者维持达到 EASI 75。在ADvocate1和ADvocate2的诱导和维持治疗期间, Lebrikizumab组63.0%的患者报告出现的不良事件,其中大多数不良事件(93.1%) 为轻至中度(Andrew Blauvelt., 2024)。
2024年9月13日,礼来Eli Lilly宣布,美国食品和药物管理局 (FDA) 批准靶向 IL-13 抑制剂 EBGLYSS™(lebrikizumab-lbkz)用于治疗尽管接受了局部处方治疗,但仍未得到很好控制的成人及体重至少 88 磅(40 公斤)以上儿童中度至重度特应性皮炎(Eli Lilly., 2024)。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。


IL-13抑制剂587
横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3