PARP抑制剂能够影响DNA的正常修复。PARP抑制剂对DNA修复的影响,包括抑制PARP的催化能力,以及阻止PARP从DNA受损部位释放。并且对于DNA修复的影响,后者更为重要。
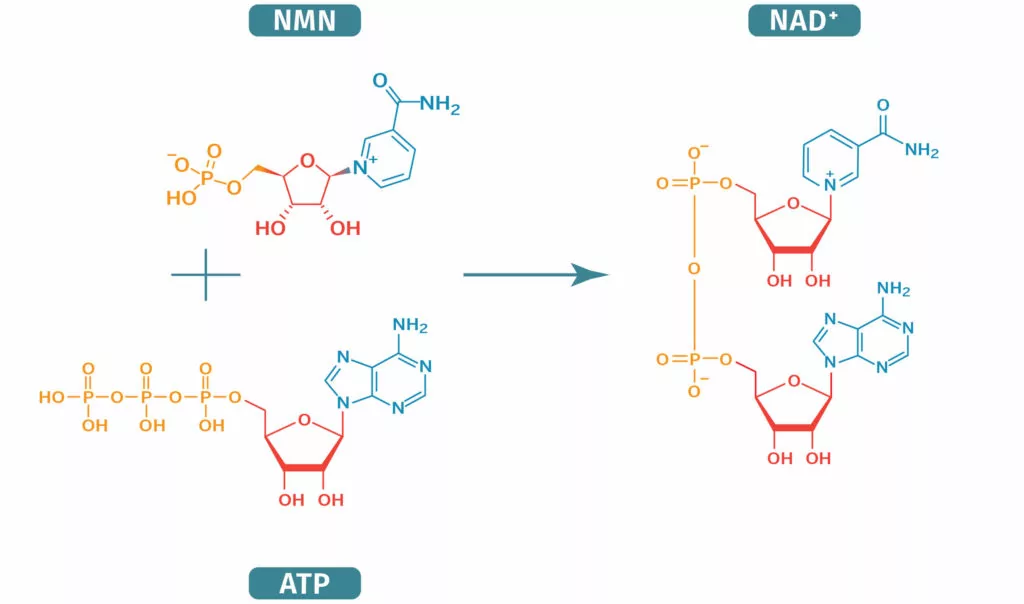
1963年,P. Chambon等人发现细胞中存在一种聚合酶,能够在NMN(烟酰胺单核苷酸)的刺激下,产生聚腺苷酸(PolyA)(P Chambon., 1963)。
1966年,P. Chambon等人确定产生的产物不是PolyA,而是PAR(聚腺苷二磷酸核糖)(P. Chambon., 1966)。因此该酶被称为聚腺苷二磷酸核糖聚合酶(PARP)。
NMN是合成NAD+(氧化型辅酶Ⅰ,烟酰胺腺嘌呤二核苷酸)的前体,而PARP能够把NAD+聚合成PAR,同时产生烟酰胺作为副产物。
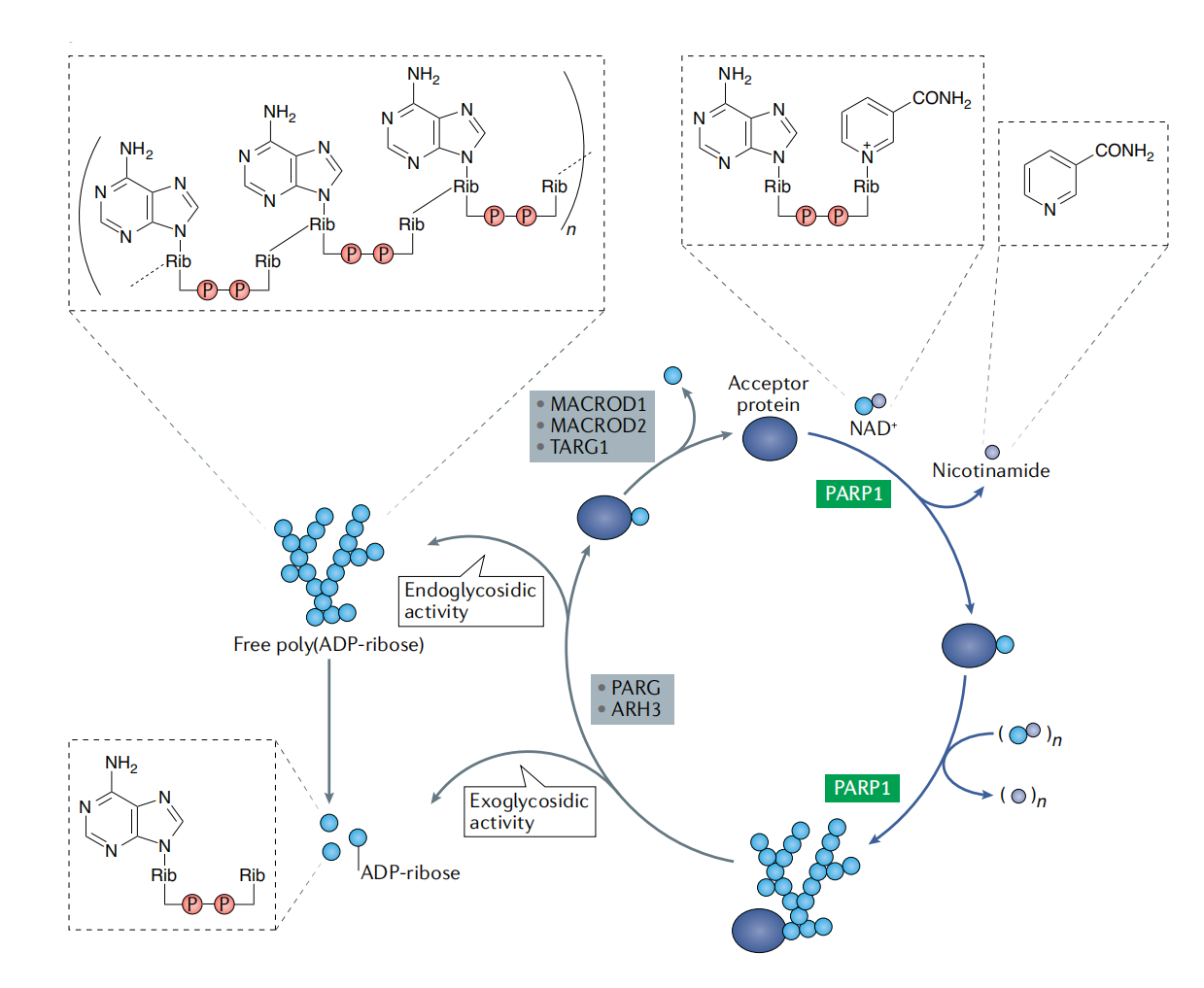
1971年,M Yamada纯化出第一种PARP,PARP1(M Yamada., 1971)。目前共发现PARP家族的17个成员,其中PARP1、PARP2、PARP5A和PARP5B能够合成腺苷二磷酸核糖聚合物,其它大多数的家庭成员主要合成腺苷二磷酸核糖单体(Nicola J Curtin., 2020)。
1975年,E G Miller发现当DNA发生损伤后,PARP活性显著增强,并推测PARP在DNA的修复中发挥作用(E G Miller.,1975)。
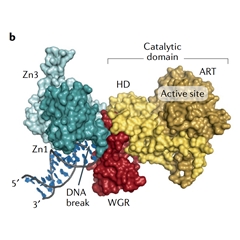
辐射、自由基或氧化剂作用下,可造成DNA单链断裂(SSB)或双链断裂(DSB)。从结构上看,PARP1包括由3个Zn指结构组成的DNA结合域、自动修饰结构域、色氨酸甘氨酸精氨酸富集(WGR)结构域和催化结构域。PARP1的DNA结合域识别受损的DNA后,会导致PARP1的构象发生变化,从而激活PARP1,催化NAD+形成PAR。在SSB的情况下,PAR能够招募DNA修复蛋白XRCC1到断裂位置,并释放PARP1,XRCC1进一步招募SSB修复(SSBR)机制中的PNKP (双功能多核苷酸激酶/磷酸酶)和APTX(Aprataxin),从而完成DNA的修复。此外,PARP1还参与DSB修复(DSBR)机制。
在DNA受损后,PARP抑制剂能够影响DNA的正常修复。与DNA毒性药物,发挥合成致死作用(Synthetic Lethality,SL)。PARP抑制剂对DNA修复的影响,包括抑制PARP的催化能力,以及阻止PARP从DNA受损部位释放。并且对于DNA修复的影响,后者更为重要(Nicola J Curtin., 2020)。
肿瘤BRCA1和 BRCA2等基因突变或基团缺陷会造成DNA同源重组修复(HRR)障碍。当SSB修复受阻后,一但发生DSB,由于存在HRR障碍,会影响DSB修复的正常进行,因此对PARP抑制剂高度敏感(Hannah Farmer., 2005; Helen E Bryant., 2005)。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3