
来那帕韦为高效、长效HIV-1衣壳抑制剂。可每半年一次皮下给药。
结构:
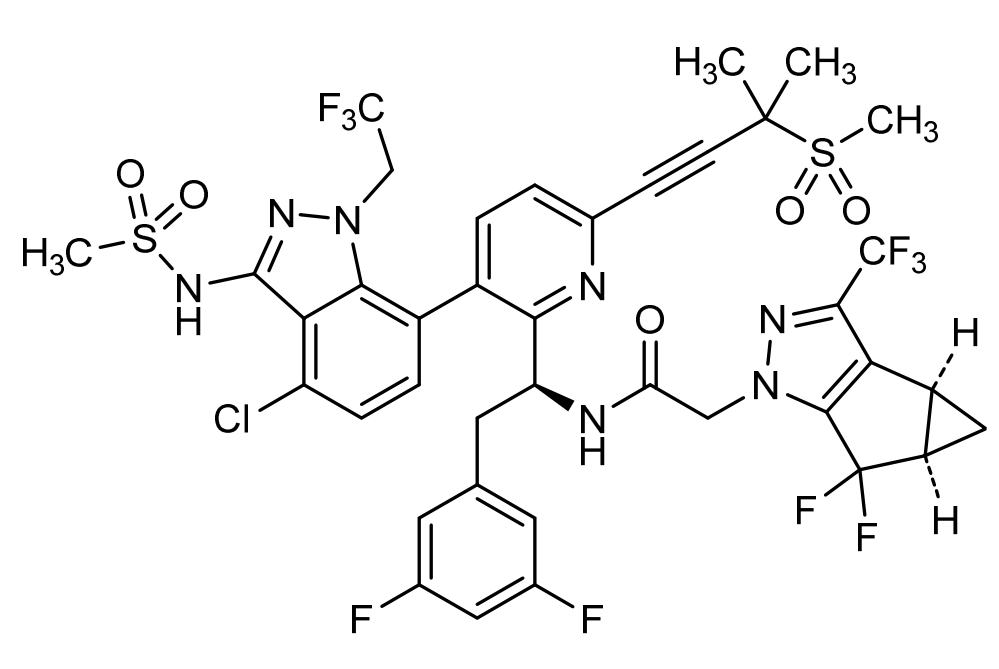
介绍:
来那帕韦(Lenacapavir,研发代号GS-6207/GS-CA2)是吉利德Gilead Sciences开发的长效HIV-1衣壳抑制剂。
2017年Winston C. Tse等人报道开发出PF74衍生物HIV-1衣壳的高效抑制剂GS-CA1(EC50 = 0.24 nM)(Winston C. Tse., 2017)。
2019年,吉利德推出GS-CA1的结构类似物GS-6207(来那帕韦,GS-CA2)(Stephen R. Yant., 2019)。
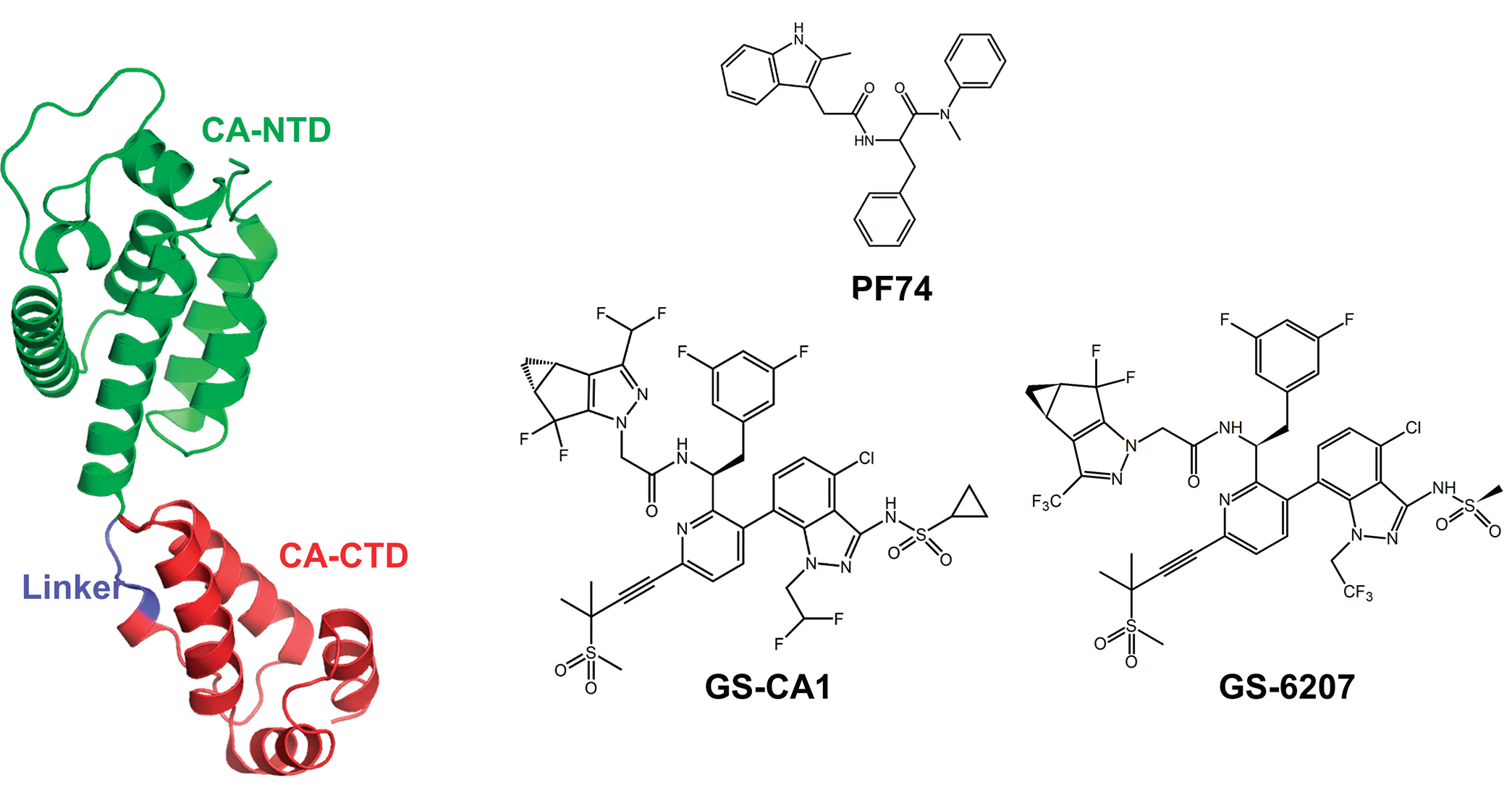
在外周血单核细胞 (PBMC)中,GS-6207对于 23 种 HIV-1 临床分离株的平均EC50 为50 pM(20-160 pM)。对大鼠和狗的研究表明,GS-6207单次皮下注射,血浆浓度维持在抑制95% HIV-1复制所需有效浓度以上的时间>12 周(Kamal Singh., 2019)。
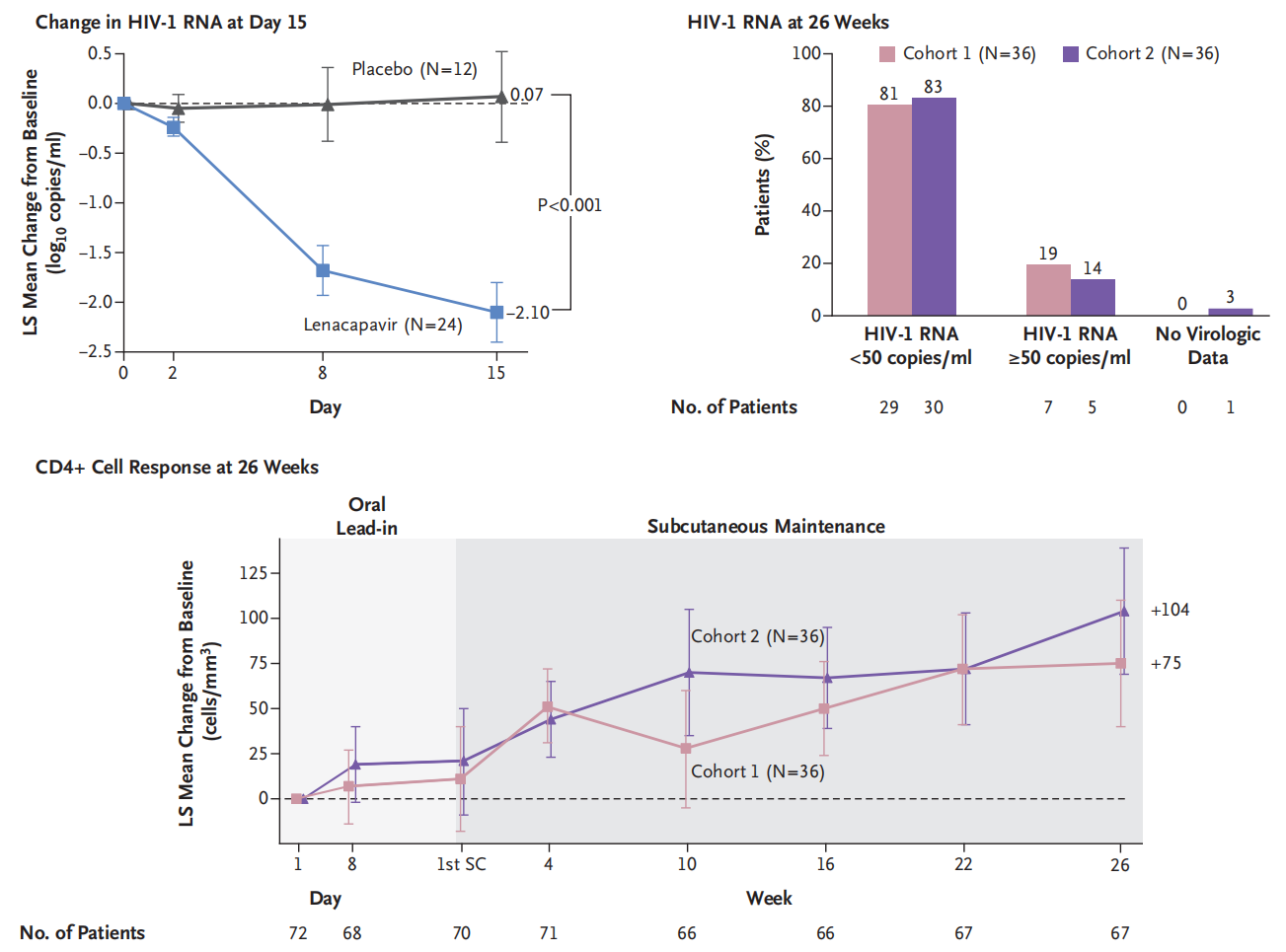
1期临床试验显示,GS-6207(450 mg)单次皮下注射,在 9 天后血浆病毒载量平均降低了2.2log10。 血浆抗病毒活性浓度维持时间> 6个月(John O Link., 2020)。
2022年,Sorana Segal-Maurer等人发表来那帕韦用于HIV-1 多重耐药感染3期临床试验CAPELLA的研究结果。该试验共入组72名患者,在原治疗基础上,分为2个列队。列队1纳入HIV-1 RNA ≥400 copies/ml的患者,按2:1比例随机分为两组,组A在第1天和第2天分别接受口服来那帕韦600mg,第8天口服来那帕韦300mg。从15开始接受927 mg来那帕韦皮下注射,每6个月一次维持治疗。组B在第1天、第2天和第8天接受相应的安慰剂,第15天、16天和第22天分别口服600mg、600mg和300mg的来那帕韦。之后进入来那帕韦皮下注射927 mg,每6个月一次的维持治疗期。列队1纳入HIV-1 RNA <400 copies/ml的患者,患者接受与列队1组A相似的给药方案。至第15天,列队1组A,24名患者中21名患者(88%) 病毒载量降低0.5 log10 copies/ml,组B的12名患者中2名患者(17%)病毒载量降低0.5 log10 copies/ml。差异71个百分点(95% CI, 35-90)。至第26周,列队1和列队2分分别有81%和83%的患者病毒载量<500 copies/ml。CD4+ 细胞计数分别增加75和104个/ml。未发生与来那帕韦相关的严重不良反应(Sorana Segal-Maure., 2022)。
2022年12月22 日,吉利德宣布FDA已经批准来那帕韦(Lenacapavir,商品名Sunlenca)联合其他抗逆转录病毒药物用于既往接受过多种治疗方案(HTE)多重耐药型(MDR)成人HIV-1 感染者。
2024年Linda-Gail Bekker等人发表来那帕韦预防顺性别女性HIV感染3期临床试验PURPOSE 1的研究结果。该研究共纳入5338名受试者,按2:2:1比例随机接受每26周皮下注射来那帕韦(Lenacapavir)、每日口服恩曲他滨替诺福韦(Ⅱ)(F/TAF)或恩曲他滨替诺福韦(F/TDF)。来那帕韦组无人发生HIV感染,显著低于恩曲他滨替诺福韦(Ⅱ)组2.02 /百人的年感染率、F/TDF组1.69 /百人的年感染率和研究背景人群2.41 /百人的年感染率(Linda-Gail Bekker., 2024)。
2024年Colleen F Kelley等人发表来那帕韦预防顺性别男性、跨性别女性、跨性别男性和非二元性别者HIV感染3期临床试验PURPOSE 2的研究结果。该研究共纳入3265名受试者。按2:1比例随机接受每 26周皮下注射来那帕韦(Lenacapavir)或每日口服恩曲他滨替诺福韦(F/TDF)。来那帕韦组2人发生HIV感染,年感染率为0.10 /百人(95% CI: 0.01- 0.37)。F/TDF组9人发生HIV感染,年感染率为0.93 /百人(95% CI: 0.43 -1.77),来那帕韦组HIV年感染率显著低于F/TDF组(RR: 0.11; 95% CI: 0.02- 0.51; P0.002)。研究背景人群的年感染率为2.37/百人(95% CI: 1.65-3.42))。与背景人群相比,来那帕韦组减少96%的HIV感染(RR: 0.04; 95% CI: 0.01- 0.18; P<0.001)。该未发现来那帕韦的安全性信号。来那帕韦组2183名受试者中26人(1.2%)和F/TDF 组1088 名受试者中3人(0.3%)因注射部位反应而停止试验(Colleen F Kelley., 2024)。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3