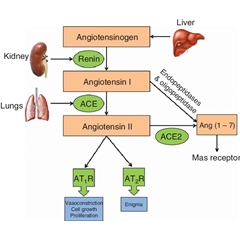
血管紧张素组成肾素-血管紧张素系统(RAS)阻断剂包括血管紧张素转换酶(ACEI)、血管紧张素Ⅱ受体拮抗剂(ARB)、肾素抑制剂和小干扰RNA(siRNA)类药物,能够阻断血管紧张素Ⅱ的形成或拮抗剂血管紧张素Ⅱ作用于血管紧张素1型受体(AT1)发挥降压作用。除了能够降低血压,还有助于逆转心肌重,改善肾小球的血流动力学效应,在保护心、脑、肾方面发挥积极的治疗意义。
肾素(Renin)由肾小球旁细胞所分泌,能够将肝脏分泌的血管紧张素原(Angiotensinogen)转化成血管紧张素Ⅰ(Ang 1)。Ang 1在肺部血管紧张素转换酶(ACE)的作用下,转化成血管紧张素Ⅱ(Ang 2),Ang 2作用于血管紧张素1型受体(AT1),引起血管收缩,产生升压作用。
肾素与与血管紧张素组成肾素-血管紧张素系统 (RAS),参与与到血压调节,并通过调节醛固酮的分泌影响体内的钠钾平衡。RAS除了参与正常的生理调节,当大量失血时,肾脏在缺血后会释放大量肾素,肾素通过RAS升高血压,并通过促进醛固酮的释放产生钠潴留,来维持血容量和器官血液灌注。当发生肾病后,肾脏的供血条件变差,也会造成肾素的过度释放,引起肾性高血压,进而引起心肌肥厚。
关于肾脏与心血管疾病建立联系,最早见于英国伦敦盖伊医院(Guy’s Hospital)的Richard Bright有在1830s记录的“医疗案例报告”,他发现肾病患者常伴有心肌肥厚。1898年在瑞典斯德哥尔摩卡罗林斯卡学院(Karolinska Institute)的芬兰生理学者Robert Tigerstedt和他的学生Per Gunnar Bergman在《Skandinavisches Archiev fur Physiologie》上发表了一篇名为“肾脏和循环(Niere und Kreislauf)”的研究论文。他们研究发现用兔肾皮质制作的提取物具有长时间的升压作用,并且升压作用与交感神经功能无关。而肾髓质提取物,未见到具有升压作用。他们将这种升压物质称之为“肾素”,并认为肾素直接作用于血管产生升压作用,是肾病患者心肌肥厚的重要原因。尽管Tigerstedt对于RAS发现具有里程碑似的意义,但Tigerstedt的发现在当时并没有获得多少关注和普通认可(John E Hall., 2003)。
研究人员真正对肾脏与血压之间的关系产生兴趣源于美国凯斯西部大学(Case Western University)的Harry Goldblatt于1934年通过使用银夹造成肾动脉缺血引起实验狗血压升高而建立起来的动物高血压模型。由于注意到高血压患者常伴有肾硬化,尽管并不怀疑高血压是造成肾硬化原因,Goldblatt希望了解肾硬化对血压的影响。由于没有肾硬化的实验模型,基于肾硬化会造成肾血流量减少,Goldblatt决定使用银夹造成实验狗肾动脉缺血,来替代肾硬化模型。Goldblatt原计划通过夹住两条肾动脉来引起血压上升,但出乎Goldblatt的意外,第一条肾动脉被夹住后,动物的血压就出现急剧上升。因此Goldblatt推断缺血的肾脏会引起“肾素”的释放,造成血压上升。

Goldblatt的实验不仅建立了动物高血压的实验模型,也推动了对于肾素的研究。1937年Harrison等人及Prinzmetal和Friedman的研究分别显示肾缺血高压模型动物肾脏提取物可升高血压,但也有其它的研究团确未观察到这种现象。1938在阿根廷生理学家Bernardo Alberto Houssay实验室工作的Juan Carlos Fasciolo通过将狗的缺血肾脏移植到颈循环,引起血压上升,证实“肾素”的存在。更为直接的证据是1938年Houssay and Taquin从肾缺血高压模型狗肾静脉抽取的血液,会引起蟾蜍后退血管强烈收缩。与此同时美国Irving Page和阿根廷Braun-Menendez的团队分别都在试图分离纯化出肾素。
1938年Page团队发现向他们纯化的肾素中滴加少量血液灌注狗尾后,会引起狗尾血管强烈的收缩,由此推测血液中含有一种能够激活肾素的物质,并称之为“肾素激活剂”。1940年Page的团队分离出肾素和“肾素激活剂”互相作用产生的升压物质,将其称为Angiotonin(血管素)。同年Braun-Menendez的团队从肾静脉血中得到一种作用时间短(3-4分钟),但能够引起血管强烈收缩的物质,将其称为Hypertensin(高紧张素)。后续的研究显示,Angiotonin和Hypertensin实际为同一种物质。1958年Page和Braun-Menendez同意使用血管紧张素(Angiotensin)这一名词,并将释放产生血管紧张素的这种底物(Page的肾素激活剂)称之为血管紧张素原。
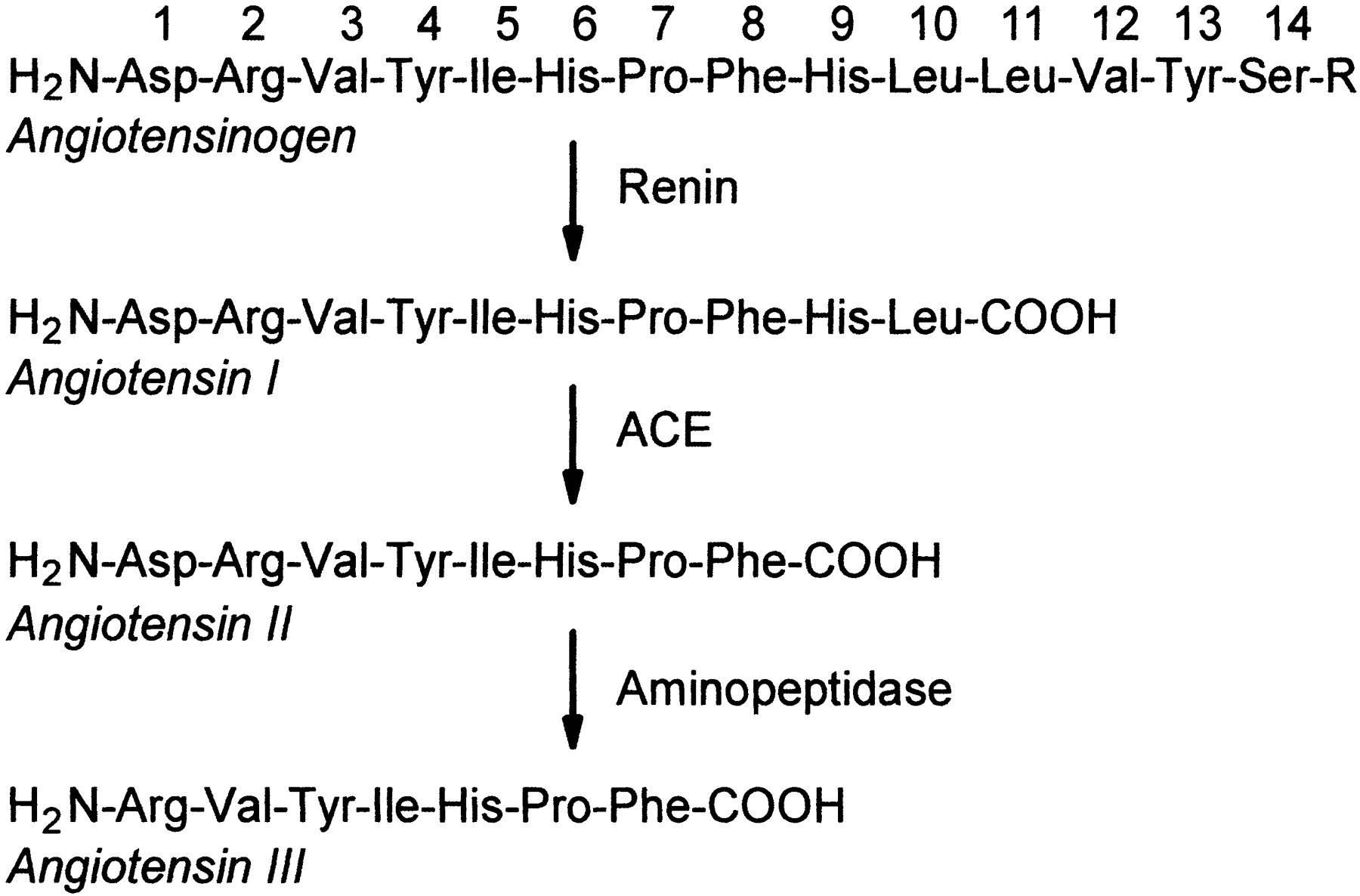
1954年美国西储大学(Western Reserve University)的Leonard Skegg纯化出血管紧张素,发现血管紧张素有两种形式,由10个肽组成的Ang 1和含8个肽的Ang 2。Ang 2由Ang 1切割两个肽后转化而来。1956年Skegg的团队发现将Ang 1转化成Ang 2的ACE,并测得Ang 2的氨基酸序列。与此同时英国的Elliott和Peart测得Ang 1的氨基酸序列。1后年Skegg又测得血管紧张素原14个肽的氨基酸序列。1957年美国Bumpus的研究团队和瑞士的 Rittel团队分别实现Ang 2的全人工合成。
从1930s到1950s关于RAS的研究主要在高血压领域,随着Ang 2纯化和实现人工合成,推动了对于RAS功能的进一步研究。1958年德国的Gross系统的论述其在RAS与钠平衡之间联系的研究成果,并推测Ang 2是调节醛固酮分泌的重要节物质,通过促进醛固酮分泌进而引起钠潴留。从1958年至1961年一系列的研究结果,证实了Gross的推测,并开启了对于肾素-血管紧张素-醛固酮轴的关注以及对心、脑、肾等靶器官影响方面的研究。
1971年Gavras H等人发现Ang 2对心脏和肾脏可产生有害作用,1972年Brunner HR发现血液肾素水平活体增高,增加脑卒中和心肌梗死的风险。1970s对于RAS阻断剂的研究为阐明RAS的功能对和靶器官的影响提供了更为强有力的武器,也为相关药物的开发奠定了基础。
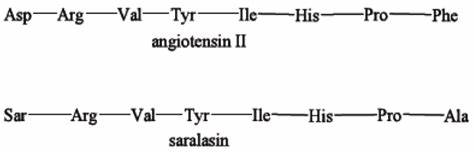
首先开发出来RAS阻断剂类药物是肽类血管紧张素Ⅱ受体拮抗剂(ARB)。肽类ARB是在Ang 2的肽链序列基础上通过替换部分氨基酸残基,得到的能够与Ang 2受体结合,但失去内在活性的Ang 2多肽类似物。其中,1971年Pals等人开发Saralasin是最常见的肽类ARB。Saralasin为Ang 2肽链第1位的天冬氨酸(Asp)残基替换为肌氨酸(Sar)残基,并将第8位的苯丙氨酸(Phe)替换成丙氨酸残基(Ala)得到的Ang 2类似物。对于Saralasin的研究为证实阻断 RAS能够降低血压和缓解心衰提供了更为直接的证据。由于Saralasin具有一定的内在活性,也使得当时的研究人员低估了ARB类药物在调节血压和钠平衡方面的治疗意义。此外Saralasin不能口服,也不适合用于慢性疾病的治疗。
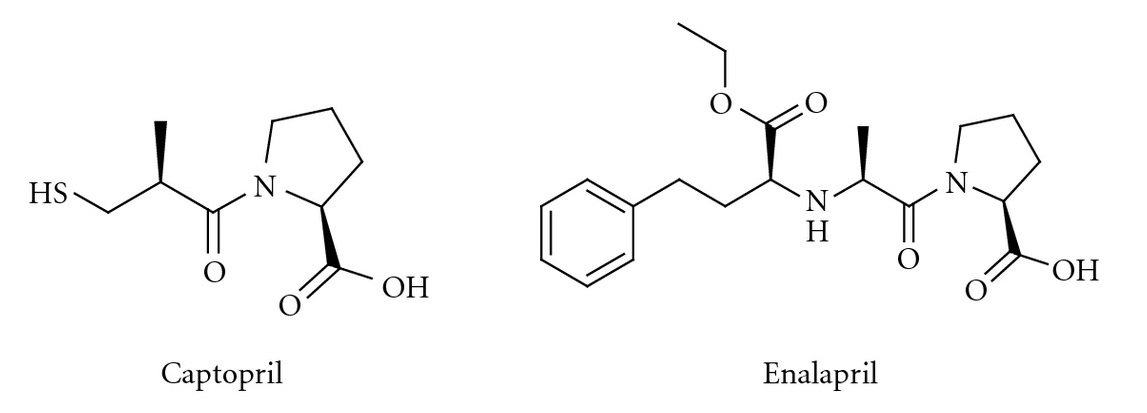
在70年代未ACE抑制剂的出现(ACEI),为RAS的研究和提供了另一种强大的工具,也推动了临床药物的开发。第一个ACE抑制剂是Teprotide(SQ20881),从巴西具窍蝮蛇(Bothrops jararaca)中分离出的含9肽的毒素。巴西科学家Sergio Ferreira发现Teprotide 能够抑制激肽酶。激肽酶分两种亚型激肽酶Ⅰ和激肽酶Ⅱ,后续的研究证实激肽酶Ⅱ与ACE是同一种物质。与Saralasin相比,Teprotide不具有内在活性。同样由于不能口服,Teprotide对高血压和心衰的治疗意义有限。1977年Squibb施贵宝的 Rubin和Cushman在羧肽酶A抑制剂结构基础上开发出非肽ACEI类药物卡托普利(Captopril),1978年默克(Merck)实验室合成出不含巯基(-SH)结构的依那普利(Enalapril)。卡托普利和依那普利的出现铺平了RAS阻断剂的临床实际应用,也推动了其它RAS阻断剂类药物如非肽类ARB类药物的开发。
Teprotide
1986年Anderson S等人首先发现,ACEI在减缓肾小球损伤方面比其他降压药物更治疗优势。与其他降压药物相比ACEI不仅能够改善肾小球入球小动脉的血流动力学,也能够改善出球小动脉的血流动力学。此外非血流动力学效应,也被认为参与到ACEI的肾脏保护作用。
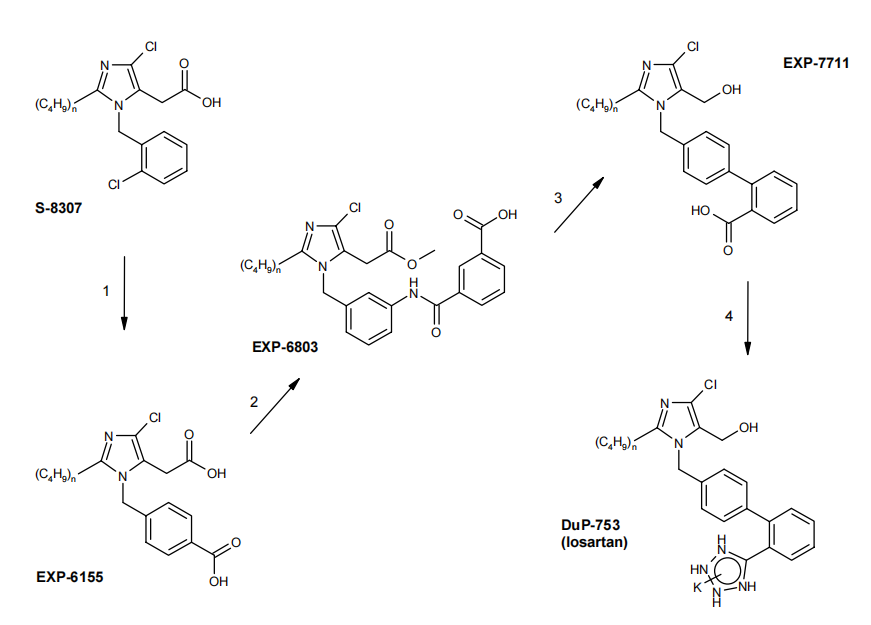
同年 DuPont杜邦公司研发人员在Taber的带领下,在武田(Takeda)化工的“苗头”化合物S-8307的基础上开发出非肽ARB药物类氯沙坦(Losartan)(Gaurab Bhardwaj., 2006)。1992年研究发现Ang 2受体分两种亚型AT1和AT2,只有AT1与Ang 2的升压作用有关。出于巧合氯沙坦只阻断AT1受体。Taber最初的目的是寄希望于通过开发不同机制的降压药物,带来不同的治疗收益。事实也证明非肽ARB类药物,保留了ACEI类药物在心、脑、肾保护方面的积极意义,成功避免了ACEI药物抑制激肽酶引起缓激肽升高造成患者出现干咳和血管神经性水肿。
RAS阻断剂类药物除ACEI类药物和ARB类药物之外,还有肾素抑制剂和小干扰RNA(siRNA)类药物。肾素抑制剂,如依那吉仑(Enalkiren)和阿利吉仑(Aliskiren),能够抑制血管紧张素原转化成血管紧张素Ⅰ。依那吉仑为二肽类肾素拮抗剂,不能口服。阿利吉仑为非肽类肾素拮抗剂,口服生物利用度仅为2.5%。相关临床试验非能证实阿利吉仑在改善治疗终点方面优于ACEI或ARB类药物,或与ACEI或ARB类药物联用后,优于单用ACEI或ARB类药物。
siRNA类药物,如Zilebesiran,能够抑制血管紧张素原在肝细胞内的合成。Zilebesiran只需半年给药一次。2期临床试验显示,Zilebesiran的300mg和600mg剂量组,与安慰剂相比降低幅度超过15mmHg(p<0.0001)。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3