来源:阿斯利康 697
2025年8月30日,阿斯利康AstraZeneca宣布Baxdrostat用于难治性高血压3期临床试验BaxHTN的研究结果发表于《新英格兰医学杂志(New England Journal of Medicine)》。

BaxHTN为多国、双盲、随机、安慰剂对照3期临床试验,共纳入796名接受两种抗高血压药物(未控制的高血压)或包括利尿剂在内三种或三种以上此类药物(顽固性高血压)治疗的患者。按1:1:1比例在背景治疗的基础上,随机接受Baxdrostat 1mg、2mg或安慰剂治疗12周。研究结果显示,Baxdrostat 1mg、2mg和安慰剂组与基线相比,最小二乘平均坐姿收缩压分别变化-14.5mmHg(95%CI,-16.5至-12.5)、-15.7mmHg(95%CI,-17.6至-13.7)和-5.8mmHg(95%CI,-7.9至-3.8)。Baxdrostat 1mg和2mg组相对于安慰剂组分别平均变化-8.7mmHg(95%CI,-11.5至-5.8)和-9.8mmHg(95%CI,-12.6至-7.0)。Baxdrostat 1mg、2mg和安慰剂组分别有6人(2.3%)、8 人(3.0%)和1人(0.4%)血钾超过6.0mmol/L。
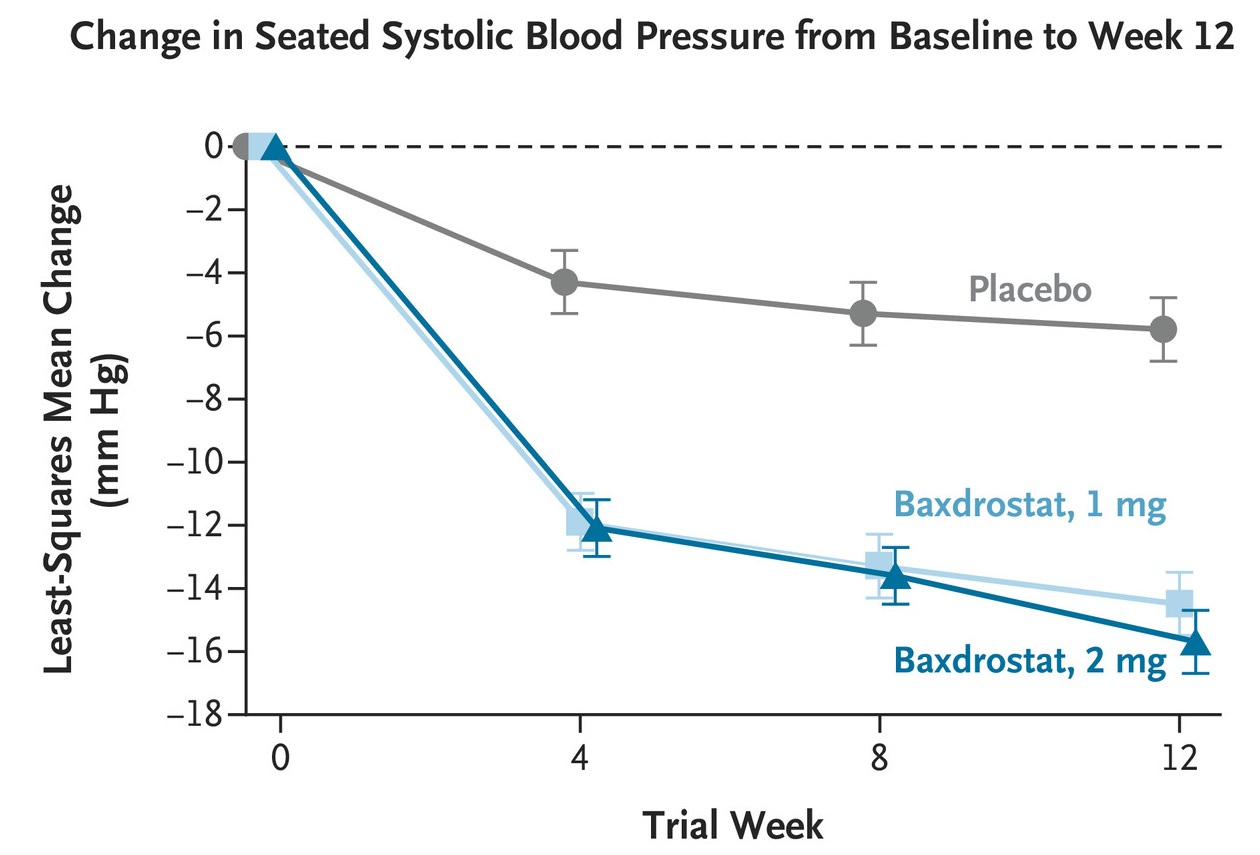
Baxdrostat为口服高选择性醛固酮合酶抑制剂,通过抑制醛固酮合酶CYP11B2,降低醛固酮。醛固酮不适当升高是难治性高血压的关键驱动因素。Baxdrostat对CYP11B2的选择远大于11β-羟化酶(CYP11B1)(Katrijn Bogman., 2017)。Baxdrostat的平均半衰期为26至31小时,可一天给药一次(Mason W Freeman., 2023)。
Baxdrostat由CinCor Pharma开发,2023年阿斯利康通过收购CinCor Pharma,将Baxdrostat纳入旗下。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

2025年8月30日,阿斯利康AstraZeneca宣布Baxdrostat用于难治性高血压3期临床试验BaxHTN的研究结果发表于《新英格兰医学杂志(New England Journal of Medicine)》。
发布日期:2025-08-30 浏览数:696

2025年6月30日,Mineralys Therapeutics宣布《美国医学会杂志(JAMA)》发表Lorundrostat 用于未控制或难治性高血压3期临床试验Launch-HTN的研究结果。
发布日期:2025-06-30 浏览数:459

2025年10月7日, 阿斯利康AstraZeneca宣布Baxdrostat难治性高血压3期临床试验Bax24研究达到主要终点。至第12周,平均24小时动态收缩压(SBP),与安慰剂相比降幅具有统计学意义。SBP在整个24 小时…
发布日期:2025-10-07 浏览数:207
横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3