
Emestedastat(Xanamem)为11β-HSD1抑制剂。2期临床试验显示,在改善pTau181>6.74pg/mL的轻度阿尔茨海默病认知方面,显示示出治疗潜力。
结构:
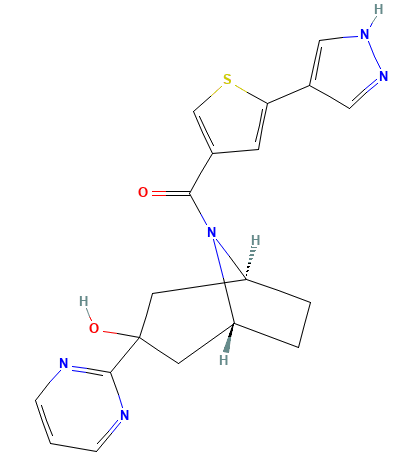
介绍:
Emestedastat(研发代号:UE2343;商品名Xanamem) 是由英国爱丁堡大学(University of Edinburgh)Corticrine公司开发的11β-HSD1抑制剂。2014年Actinogen收购Corticrine获得UE2343的开发权利。
UE2343是在化合物1基础进行优化得到的产物(Scott P Webster., 2017)。优化的目标是提高候选药物对于血脑屏障的通透性(使用CNS MPO进行评价),改善在大脑中的分布。对1氮杂双环3ʹ位的羟基和苯基进行替换后得到2-9。其中4(UE2343)和7表现出更高的血液和脑组织浓度。
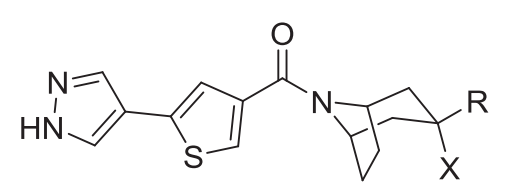
| ID | X | R | IC50 (nM) [n] | CNS MPO score | Plasma Cmax (ng·mL−1) | Brain Cmax (ng·mL−1) | Brain : plasma ratio |
|---|---|---|---|---|---|---|---|
| 1 | OH |
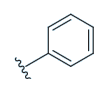 |
22 ± 2 [2] | 5.0 | 419 ± 28 | 29 ± 10 | 0.07 |
| 2 | OH |
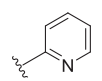 |
26 ± 8 [3] | 5.4 | 1270 ± 330 | 31 ± 12 | 0.02 |
| 3 | OH |
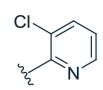 |
12 ± 0 [1] | 5.0 | 115 ± 48 | 36 ± 12 | 0.31 |
| 4 | OH |
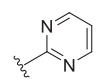
|
24 ± 15 [31] | 5.2 | 1539 ± 657 | 173 ± 80 | 0.11 |
| 5 | OH |
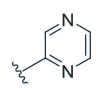
|
37 ± 3 [2] | 5.2 | 589 ± 161 | 19 ± 17 | 0.03 |
| 6 |
 |
F | 22 ± 10 [4] | 5.4 | 399 ± 99 | 108 ± 54 | 0.27 |
| 7 | F |
 |
7 ± 4 [5] | 5.4 | 1526 ± 212 | 374 ± 184 | 0.24 |
| 8 | CN |
 |
15 ± 0 [1] | 5.6 | 291 ± 74 | 9 ± 3 | 0.03 |
| 9 | CN |
 |
13 ± 3 [3] | 5.3 | 230 ± 33 | 15 ± 1 | 0.07 |
对4和7进一步评价显示4对于肝微粒体更加稳定,生物利用度更高,并且对于hERG离子通道的影响更小。
| Compound | 4 | 7 |
|---|---|---|
| Human 11β‐HSD1 IC 50 in HEK293 cells (nM) [n] | 24 ± 15 [31] | 7 ± 4 [5] |
| Liver microsomal stability (% parent at 30 min) [n] | Human | Human |
| 99 ± 1 [3] | 51 ± 3 [3] | |
| Dog | Dog | |
| 92 ± 5 [3] | 74 ± 1 [3] | |
| Rat | Rat | |
| 74 ± 1 [3] | 45 ± 5 [3] | |
| Pharmacokinetics in dog | ||
| Oral Cmax (ng·mL−1) | 4590 ± 546 | 3100 ± 908 |
| Cl (mL·min−1·kg−1) | 4.68 ± 1.12 | 8.68 ± 2.03 |
| t 1/2 (h) | 2.79 ± 0.84 | 3.21 ± 1.61 |
| Oral AUC(0➔∞) (ng.h·mL−1) | 31 730 ± 3746 | 9208 ± 2005 |
| % F | 170 ± 40 | 90 ± 40 |
| Plasma protein binding (% unbound) [n] | Human | Human |
| 30 ± 2 [2] | 11 ± 2 [2] | |
| Dog | Dog | |
| 44 ± 0 [1] | 11 ± 0 [1] | |
| Rat | Rat | |
| 26 ± 0 [2] | 10 ± 1 [2] | |
| Human hERG IC 50 (μM) [n] | >30 ± 0 [2] | 3.1 ± 0.6 [2] |
| Aqueous solubility at pH 7.4 (mg·mL −1 ) [n] | 0.200 ± 0 [1] | 0.006 ± 0 [1] |
PET CT显示阿尔茨海默症受试者使用UE2343 10mg/天,即可在阿尔茨海默病和认知正常个体中达到较高的脑组织11β-HSD1占用率(Victor L Villemagne., 2024)。
2024年,Jack Taylor等人发表了Xanamem®治疗轻度阿尔茨海默病的2期临床试验结果。Xanamem®在改善34 例血浆pTau181>6.74pg/mL的轻度阿尔茨海默病患者《临床痴呆评分箱(CDR-SB)》评分方面,与安慰剂相比相对降低0.6(p=0.09),显示出治疗潜力。同时该试验显示血浆pTau181>6.74pg/mL(H)的患者比pTau181≤6.74pg/mL(L)进展速度更快(Jack Taylor., 2024)。
2024年8月12日,Actinogen Medical公布了Xanamem治疗重度抑郁症合并认知功能障碍2a期临床试验XanaCIDD 的研究结果。至第6周治疗结束,165名至少接受一次治疗评估患者《蒙哥马利抑郁评定量表(MADRS)》评分,Xanamem组改善1.5分,标准化治疗效应(Cohen’s d, Cd)= 0.24,p = 0.11。在治疗结束的第四周,MADRS改善2.7分,Cd = 0.43,p = 0.02达到显著差异。81名抑郁症状较轻患者,在治疗结束时,MADRS改善3.6分,Cd = 0.88,p = 0.02达到显著差异。在治疗结束的第四周,MADRS改善3.6分,Cd = 0.87,p = 0.03。31名Xanamem单药治疗患者MADRS改善4.3 分,Cd = 0.64,p = 0.06。在该试验主要指标,三项关于注意力和工作记忆《CogState量表》计算机化认知测试注意力综合评分方面,Xanamem组尽管得到在大幅改善,但与安慰剂组相比未达到显著差异(Xanamem组和安慰剂组分别平均0.3 和0.4分)。安慰剂组出乎意料的改善作用,削弱了两组之间的差异。在试验期间Xanamem 安全性和耐受性良好,与之前的试验结果相一致(Actinogen., 2024)。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。


11-β-羟基类固醇脱氢酶1抑制剂|11β-HSD1抑制剂547
横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3