
Afamitresgene autoleucel为通过编码靶向HLA-A*02呈递人类黑色素瘤抗原A4(MAGE-A4)T细胞受体(TCR)的EF1α启动子HIV自我灭活(SIN)慢病毒载体,转染自体CD4+和 CD8+ T细胞制备而成T细胞受体(TCR)疗法。
结构:
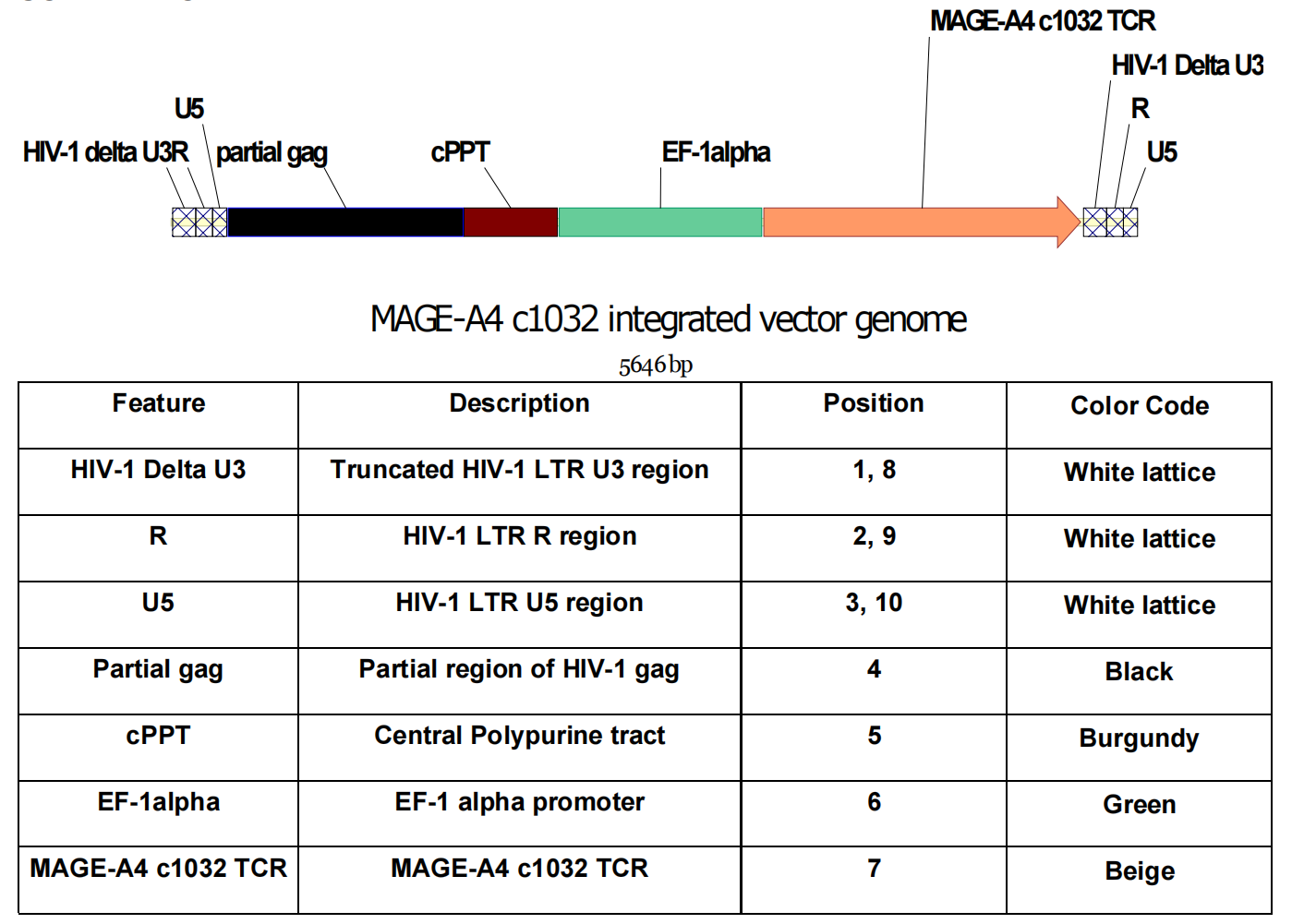
介绍:
Afamitresgene autoleucel(afami-cel,研发代号ADP-A2M4,商品名Tecelra)是Adaptimmune Therapeutics开发的T细胞受体(TCR)疗法。通过编码靶向HLA-A*02呈递人类黑色素瘤抗原A4(MAGE-A4)T细胞受体(TCR)的EF1α启动子HIV自我灭活(SIN)慢病毒载体,转染自体CD4+和 CD8+ T细胞制备而成。
1958年Jean Dausset发现人类与小鼠相似的MHC(主要组织相容性复合体)系统,称之为MAC,也被称为HLA(人类白细胞抗原),并 鉴定出第一种HLA(HLA-2A)(Laurent Degos., 2009)。HLA-2A包括多种同位变异体,其中HLA-A*02:01最为常见。
1991年,P van der Bruggen等人鉴定出能被 HLA-1A呈递的肿瘤抗原MZ2-E(现称为MAGE-A1,人类黑色素瘤抗原A1)(P van der Bruggen., 1991)。由于MAGE-A1主要在正常睾丸和多种肿瘤组织中表达,因此也为称为癌症-睾丸抗原,之后鉴定出癌症-睾丸抗原家族的多个成员。
1999年,E De Plaen等人鉴定出8种MAGE-A同源基因MAGE-A1-8(E De Plaen., 1999)。同年M T Duffour等人确定MAGE-A4由 HLA-A2呈递(M T Duffour., 1999)。MAGE-A4在非小细胞肺癌 (NSCLC)、黑色素瘤、膀胱癌、头颈癌和胃食管癌等肿瘤中高度表达(Joseph P Sanderson., 2019)。
afami-cel靶向HLA-A*02呈递的MAGE-A4序列GVYDGREHTV(Joseph P Sanderson., 2019)。
2024年,Sandra P D'Angelo等人发表Afamitresgene autoleucelI治疗晚期滑膜肉瘤和粘液样圆细胞脂肪肉瘤的2期临床试验SPEARHEAD-1列队1的研究结果。SPEARHEAD-1列队1共入组52名患者其中包括44名滑膜肉瘤患者,8名脂肪肉瘤患者。患者接受平均3线的预治疗,中位数随访时间为32.6个月。Afamitresgene autoleucel治疗患者总体缓解率为37%(19/52; 95% CI 24-51),滑膜肉瘤患者者总体缓解率为39%(17/44; 24-55),粘液样圆细胞脂肪肉瘤患者总体缓解率为9%(2/9; 3-65)。71%(37/52)的患者发生细胞因子释放综合征,其中1 例为3 级事件。最常见的≥3级不良事件为血细胞减少(淋巴细胞减少 50 例 [96%],中性粒细胞减少 44 例 [85%],白细胞减少 42 例 [81%])。没有发生与治疗相关的死亡事件(Sandra P D'Angelo., 2024)。
2024年8月1日,Adaptimmune Therapeutics宣布美国食品药品监督管理局(FDA)加速批准 TECELRA ®(Afamitrisgene Autoleucel)用于治疗既往接受过化疗治疗,HLA-A*02:01P、 -A*02:02P、 -A*02:03P、或-A*02:06P阳性,MAGE-A4抗原阳性成人无法切除或转移性滑膜肉瘤(Adaptimmune., 2024)。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。


过继细胞疗法|CAR-T|TCR628

过继细胞疗法|CAR-T|TCR568

过继细胞疗法|CAR-T|TCR561
横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3