
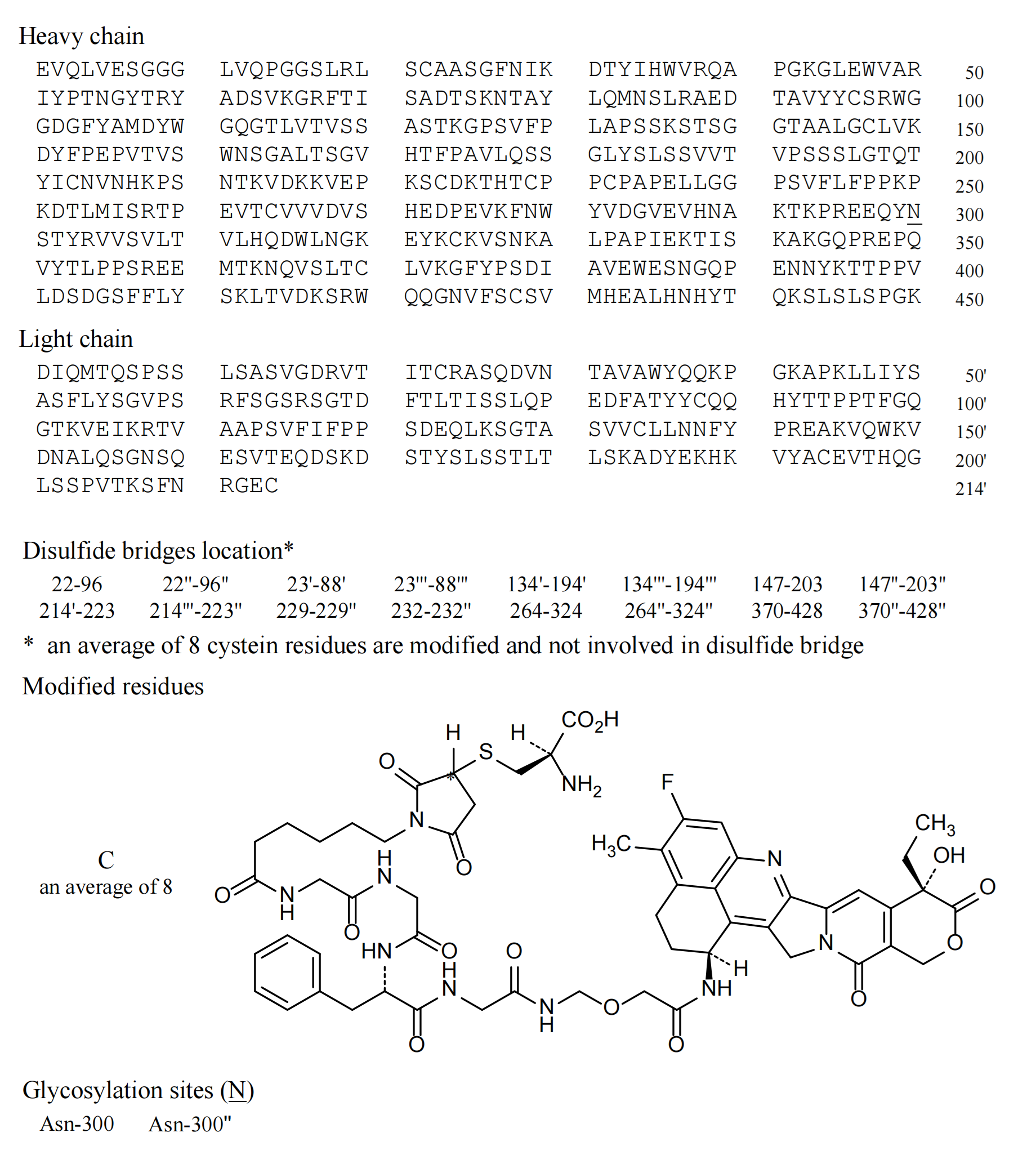
德曲妥珠单抗是靶向HER2(人表皮生长因子受体-2)的抗体偶联药物(ADC)。由曲妥珠单抗通过链接子与拓扑异构酶-Ⅰ抑制剂DXd连接组成。
结构:
介绍:
德曲妥珠单抗(Trastuzumab Deruxtecan,商品名:优赫得Enhertu;研发代号:DS-8201a)是第一三共开发靶向HER2(人表皮生长因子受体-2)的抗体偶联药物(ADC)。2019年3月,阿斯利康和第一三共达成全球合作,在除日本以外的市场(第一三共在日本拥有独家代理权)共同开发和商业化德曲妥珠单抗。
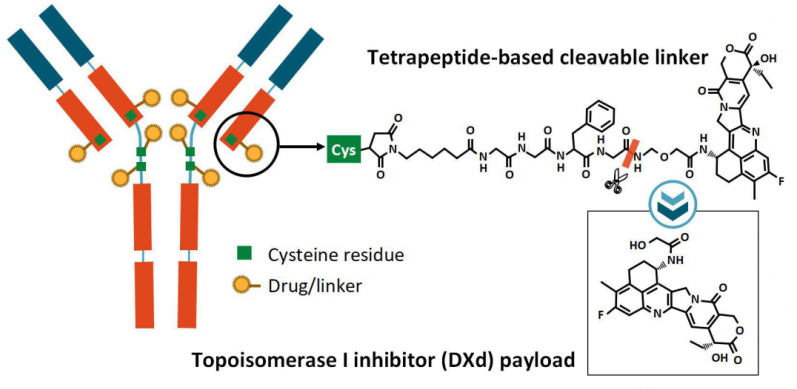
德曲妥珠单抗由人源化抗HER2单克隆抗体曲妥珠单抗通过链接子与拓扑异构酶-Ⅰ抑制剂(喜树碱类衍生物DXd)连接组成。1个抗体对应平均8个DXd(DX-8951f),由抗体的平均8个半胱氨酸残基接入马来酰亚胺己酸-甘氨酸-甘氨酸-苯丙氨酸-甘氨酸(GGFG)肽链接子并与DXd相链,药物与抗体的比值DAR=8。德曲妥珠单抗在血液中稳定,进入肿瘤细胞后,GGFG链接子在溶酶体中在组织蛋白酶的作用下与DXd的氨基甲氧基接头断开。释放出DXd。由于Trastuzumab Deruxtecan的DAR高达8,并且DXd具有良好的膜通透性,能够放散到旁边的肿瘤细胞产生旁观者效应(Yusuke Ogitani., 2016; Seetharamsing Balamkundu., 2023)。
2020年Shanu Modi等人发表德曲妥珠单抗用于接受过恩美曲妥珠(Trastuzumab Emtansine)治疗HER2阳性转移性成人乳腺癌患者2期临床试验; DESTINY-Breast01的研究结果。 德曲妥珠单抗的治疗反应率为60.9%(95% CI: 53.4 - 68.0)。中位治疗反应时间为14.8个月(95% CI: 13.8-16.9)。中位无进展生存期为16.4个月(95% CI: 12.7 至未达到)。患者发生≥3级不良事件包括是中性粒细胞计数减少(20.7%)、贫血(8.7%)和恶心(7.6%)。13.6%的患者发生间质性肺病,10.9%为1级或2级,0.5%为3级或4级,2.2%为5级(Shanu Modi., 2020)。
2019年,FDA批准德曲妥珠单抗用于既往接受过两种或两种以上抗 HER2方案的不可切除或转移性HER2阳性成人乳腺癌。
2021年,FDA批准德曲妥珠单抗用于治疗既往接受过曲妥珠治疗方案的成年局部晚期或转移性HER2阳性胃癌或胃食管结合部(GEJ)腺癌。
2022年,FDA批准德曲妥珠单抗用于往接受过抗 HER2方案并在六个月内复发的不可切除或转移性 HER2 阳性成人乳腺癌。
同年FDA批准德曲妥珠单抗批准用于治疗既往接受过辅助化疗并在6个月内出现转移或进展的不可切除或转移性HER2低表达(IHC 1+或IHC 2+/ISH-)成人乳腺癌。
同样是同年FDA批准德曲妥珠单抗批准治疗不可切除或转移性HER2 (ERBB2) 突变非小细胞肺癌 (NSCLC)。
2024年,FDA批准德曲妥珠单抗用于既往接受过全身治疗且没有令人满意的替代治疗选择的不可切除或转移性 HER2 阳性(IHC 3+)成人实体瘤。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3