
Otelixizumab是由GlaxoSmithKline和TolerRx联系合开发的用于预防1型糖尿病(T1DM)的非糖基化抗CD3类IgG1抗体。由于可能引起EB病毒感染,导致该药物的开发目前处于停滞。
结构:
介绍:
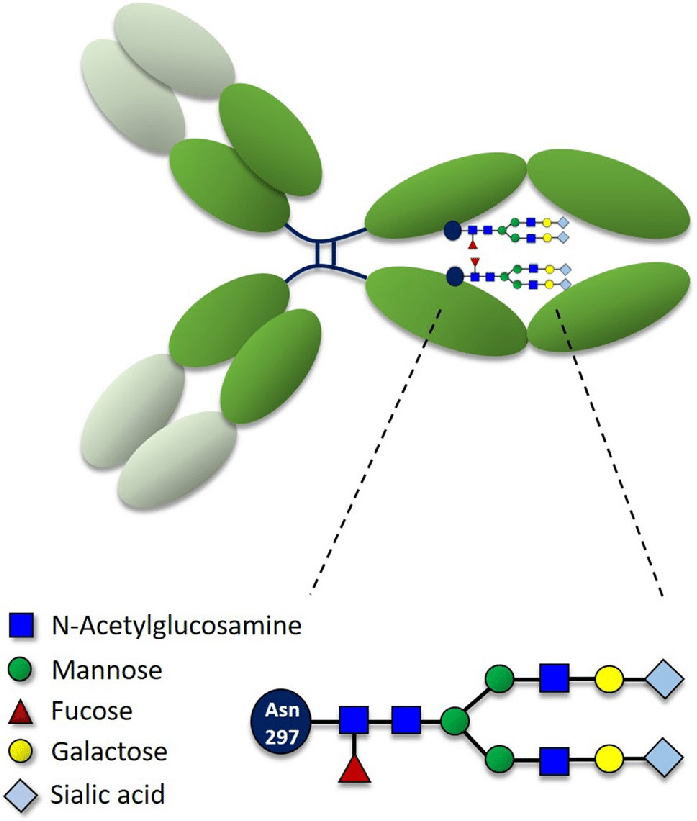
1991年英国剑桥大学(Cambridge University)的Herman Waldmann研究团队在鼠源性抗CD3抗体YTH12.5的基础上开发了一种人鼠嵌合的IgG1抗体。抗CD3抗体对T细胞的作用具有双重性,抑制T细胞的同时,其Fc端可被单核吞噬细胞等免疫细胞的Fc受体识别,导致促进T细胞活化和炎症因子TNF-α等大量释放,发生可能致命的细胞因子释放综合征(CRS)。因此之后Waldmann研究团队对嵌合抗体做了进一步优化。IgG1重链的第297位的天冬酰胺(Asn)残基会发生糖基化修饰,使IgG1抗体易被Fc受体识别。因此,Waldmann研究团队尝试用其它氨基酸替代第297位的Asn,以阻止嵌合抗体被Fc受体识别。与另一个抗CD3抗体药物Teplizumab相似,改造后的嵌合抗体(第297的Asn用丙氨酸Ala替换),通过肾移植患者的临床试验,初步验证了人体的安全性和有效性。
2005年比利时布鲁塞尔自由大学(Vrije Universiteit Brussel)的Bart Keymeulen发表了该改造后的嵌合抗体(ChAglyCD3)首次针对新发1型糖尿病(T1DM)患者的2期临床试验结果。ChAglyCD3能够更好的维持了胰岛β细胞的功能,但也发现ChAglyCD3会引起中度的流感样症状以及由EB病毒感染引发的暂时单核细胞增多症。此时ChAglyCD3R,由TolerRx进行商业开发,开发编号为TRX4。
2006年TRX4获得美国FDA治疗新发T1DM的孤儿药认定,2007年葛兰素史克GlaxoSmithKline与TolerRx签订协议,获得授权共同开发TRX4(Otelixizumab)。受可能引起EB病毒感染问题影响,2008年和2010年TolerRx分别启动了小剂量(3.1mg)Otelixizumab针对岁新发T1DM患者的3期临床试验DEFEND-1和DEFEND-2。2011年GlaxoSmithKline和TolerRx发布公告,Otelixizumab在DEFEND-1试验的主要指标C肽变化水平未达到试验终点,DEFEND-1和DEFEND-2随之中止。
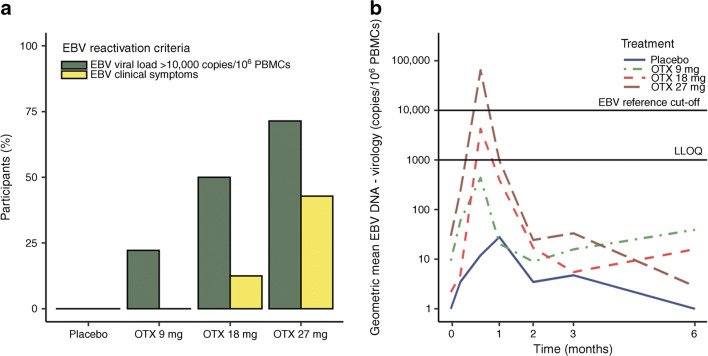
2014年GlaxoSmithKline重新发起了一项1/2期临床试验,用于评价Otelixizumab在9mg、18m以及27mg剂量下治疗新发T1DM的安全性和有效性。2021年Keymeulen在2期《Diabetologia》发表了该项试验的结果。18mg和27mg组中部分患者出现有症状的EB病毒感染,而9mg剂量组尽管无患者出现有症状的EB病毒感染,但仍有部分患者的EB病毒水平高于最低检测线。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3