
替利珠单抗是人源化抗CD3的IgG1抗体,是FDA批准的第一个用于预防1型糖尿病(T1DM)的药物,延缓T1DM进入第3期(症状期)。
结构:

介绍:
替利珠单抗(Teplizumab,商品名:特瑞可Tzield;研发代号:TN-10/MGA031/hOKT3γ1 (Ala-Ala))是Provention开发的人源化抗CD3的IgG1抗体,是FDA批准的第一个用于预防1型糖尿病(T1DM)的药物,用于延缓T1DM进入第3期(症状期)。
2023年3月13日赛诺菲Sanofi宣布以29亿美元的价格收购Provention,将替利珠单抗囊括于旗下(Sanofi., 2023)。
2000年美国芝加哥大学(University of Chicago)Jeffrey A. Bluestone的研究团队在2月期《Cellular Immunology》上发表的论文介绍了他们开发的人源化OKT3抗体的修饰抗体,其中包括hOKT3γ1 (Ala-Ala)。OKT3属于抗CD3抗体,且有抗T细胞作用。OKT3为鼠源性抗体,易产生抗OKT3抗体,丧失疗效,OKT3对T细胞的作用具有双重性,还会表现出促进T细胞的活化。其Fc端可被单核吞噬细胞等免疫细胞的Fc受体识别,进而促进T细胞活化和炎症因子TNF-α等大量释放,导致发生可能致命的细胞因子释放综合征(CRS)。为子防止发生CRS,Bluestone的研究团队对OKT3人源化IgG1和IgG4抗体的Fc的第234位、235位或318位段进行修饰,使用丙氨酸(Ala)代替原来的氨基酸残基。在多修饰产物中筛选出第234位、235位OKT3人源化IgG1抗体修饰物hOKT3γ1 (Ala234-Ala235)。hOKT3γ1 (Ala-Ala)与Fc受体的两个亚型FcγRⅠ和FcγRⅡ和结合能力比修饰前分别下降了100多倍,并且hOKT3γ1 (Ala-Ala)与血清补体系统的C1q也缺乏结合能力,从而避免与C1q结合后介导发生补体依赖的细胞毒性(CDC)反应。
1998年hOKT3γ1 (Ala-Ala)选择在7名肾移植患者开展1期临床试验,试验结果初步确认了hOKT3γ1 (Ala-Ala)在免疫抑制方面的安全性和有效性。1999年美国哥伦比亚大学(Columbia University)的Kevan C Herold启动了hOKT3γ1 (Ala-Ala)治疗1型糖尿病(T1DM)的1/2期临床试验,并在2002年5月期《The New England journal of medicine》和2005年6月期《Diabetes》上发表第1年和第2年的治疗随访结果。Herold的试验初步显示对于6周内确诊的T1DM新患者,接受14天hOKT3γ1 (Ala-Ala)治疗后,无论是1年还是第2年的糖化血红蛋白(HbA1c)和胰岛素日使用量都显著低于对照组,提示hOKT3γ1 (Ala-Ala)能够保护胰岛β细胞,减缓T1DM患者胰岛素分泌水平的持续下降。
2005年MacroGenics公司和Herold会谈后,获得授权进行hOKT3γ1 (Ala-Ala)的后续商业开发,项目开发编号为MGA031。MGA031于2006年获得美国FDA治疗新发T1DM的孤儿药认定(ODD),并于同年进入2/3期临床试验(Protégé),用于评估MGA031对于12周内新确诊T1DM患者的临床疗效。2007年10月MacroGenics和Eli Lilly签订协议,共同推进MGA031的商业开发。2010年Eli Lilly公布了Protégé试验的第1年随访结果,由于1年随访的主要终点指标HbA1c<6.5%并且胰岛素日剂量<0.5 U/kg的患者占比,Teplizumab组比与安慰组相比未见显著差异,Protégé试验未达到主要疗效终点。
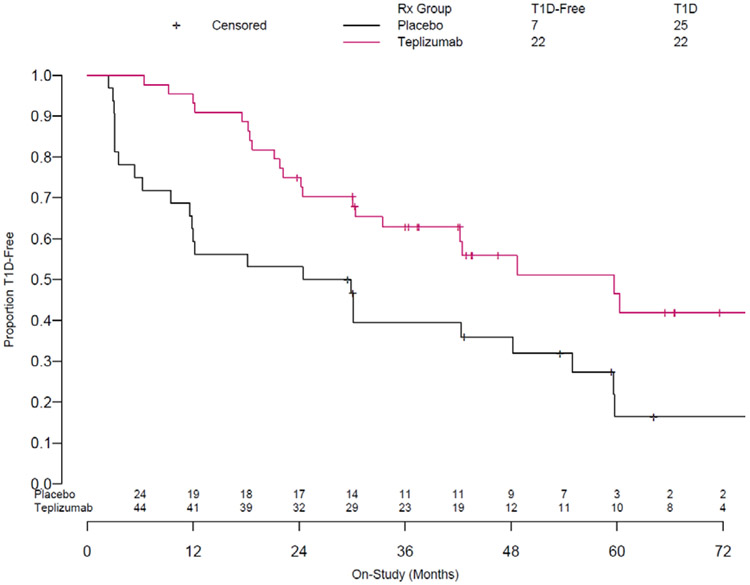
尽管MacroGenics和Eli Lilly暂停了Teplizumab后续试验,Herold在美国国家糖尿病、消化和肾脏疾病研究所(NIDDK)的资助下,针对2种或2种以上的胰岛自身抗体呈阳性,血糖控制不佳,尚无明显临床症状的T1DM的高风险人群启动了Teplizumab预防T1DM的2期临床试验(At-Risk)。2015年美国年青少年糖尿病基金会(JDRF)、内分泌学会(TES)和美国糖尿病协会(ADA)共同制定了1型糖尿病(T1DM)的分期标准。为T1DM预防药物的临床试验设计提供了理论依据。2018年基于Teplizumab预防T1DM的初步结果,Provention从MacroGenics和Eli Lilly购买了Teplizumab的开发权益。2019年Heroldd在6月期《The New England journal of medicine》上发表了Teplizumab预防T1DM的2期临床试验结果。76名入组患者中,Teplizumab组第一年T1DM的确诊率为7%,而安慰剂对照组为44%。2021年在3月期 《Science Translatinal Medicine》上发表了Teplizumab(TN-10)长期随访结果,Teplizumab组T1DM的发生率为45%,远低于对照组的78%,Teplizumab组T1DM的发病中位数为59.6个月,也远高于安慰剂对照组27.1 个月。
2021年5月FDA的专家咨询委员会10比7投票建议FDA批准Teplizumab(Tzield)。2021年6月FDA根据专家咨询委员会投票中的反对意见,要求Provention充补额外的药代动力学/药效学(PK/PD)数据。
2022年10月6日Sanofi赛诺菲与Provention的签订协议,以2千万美元预付款的形式获得Teplizumab授权的独家优先谈判权,并承诺向Provention股权投资3.5 千万美元(Sanofi., 2022)。
2022年11月27日,FDA批准根据Provention补充的PK/PD数据,批准Tzield用于延缓T1DM病进入第3期(症状期)。
2023年10月18日Teplizumab对于新发T1DM的β细胞保护作用3期临床结果在《The New England Journal of Medicine》发表。PROTECT试验结果显示,在研究终点Teplizumab治疗组的C肽水平显著高于安慰剂组,平均高出0.13 pmol/mL。Teplizumab组94.9%的受试者能够维持C肽峰值水平≥0.2 pmol/mL,而安慰剂组为79.2%(p<0.001)(Eleanor L Ramos., 2023)。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3