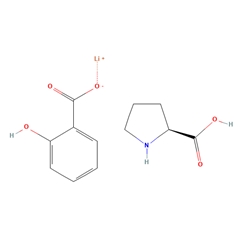
水杨酸锂L-脯氨酸共晶是Alzamend开发的第二代锂剂,动物实验显示能够降低阿尔茨海默症模型鼠β淀粉样蛋白和tau蛋白水平,及认知功能。目前已进入2期临床试验,有望成为一种不需要监测血锂浓度的抗阿尔茨海默症药物。
结构:
介绍:
1996年,美国宾夕法尼亚大学(University of Pennsylvania)的Peter S Klein和美国哈佛大学(Harvard University)的Douglas A Melton发现锂具有抑制糖原合成酶激酶-3β(GSK-3β)的作用。(P S Klein et al., 1996)。由于GSK-3β在阿尔茨海默症(AD)tau蛋白的异常磷酸化的过程中发挥重要作用,受此启发1997年西班牙马德里自治大学(Universidad Autónoma de Madrid)的Javier Diaz-Nido研发团队通过动物模型表明锂剂可以抑制tau蛋白在神经元内的磷酸化(J R Muñoz-Montaño et al., 1997)2年之后Javier Diaz-Nido研究团队进一步发现锂可以抑制在阿尔茨海默症另一种病理标志β淀粉样蛋白引起的神经退行性病变(G Alvarez et al., 1999) 。
2011年巴西的圣保罗大学(Universidade de SãoPaulo)Gattaz研究团队的单中心随机双盲安慰剂对照试验表明血锂浓度控制在0.25–0.5 mmol/l,维持治疗1年,可显著降低患者脑脊液中的磷酸化tau蛋白和β淀粉样蛋白水平,并改善评价患者认知功能的《阿尔茨海默病评估-认知(ADAS-Cog)》量表的评分(Orestes V Forlenza et al., 2011)。
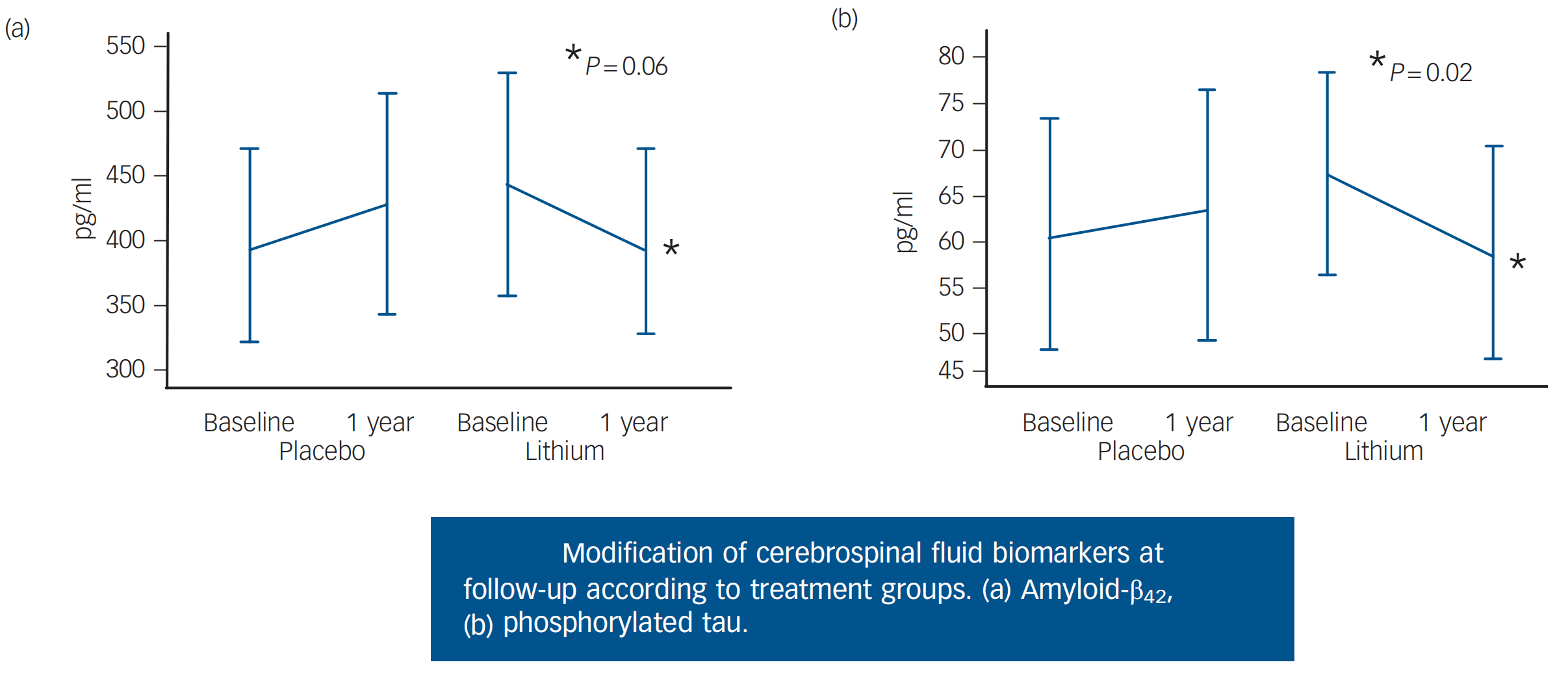
由于血锂浓度超过1.4 mmol/l就可能出现锂中毒,尽管巴西Gattaz团队已经使用了较低剂量的锂剂,但仍然需要监测血锂浓度。2013年巴西圣保罗圣塔卡萨医学院(Faculdade de Ciencias Medicas da Santa Casa de Sao Paulo) Marielza Andrade Nunes等人发表的论文显示使用微量锂剂(300μg,相当于常规剂量的千分之一)依旧有助于稳定患者的认知功能(Nunes et al., 2013)。尽管Nunes等人的研究,避免了血锂监测,但该项试验缺少脑脊液磷酸化tau蛋白和β淀粉样蛋白等关键生化指标上的支持。
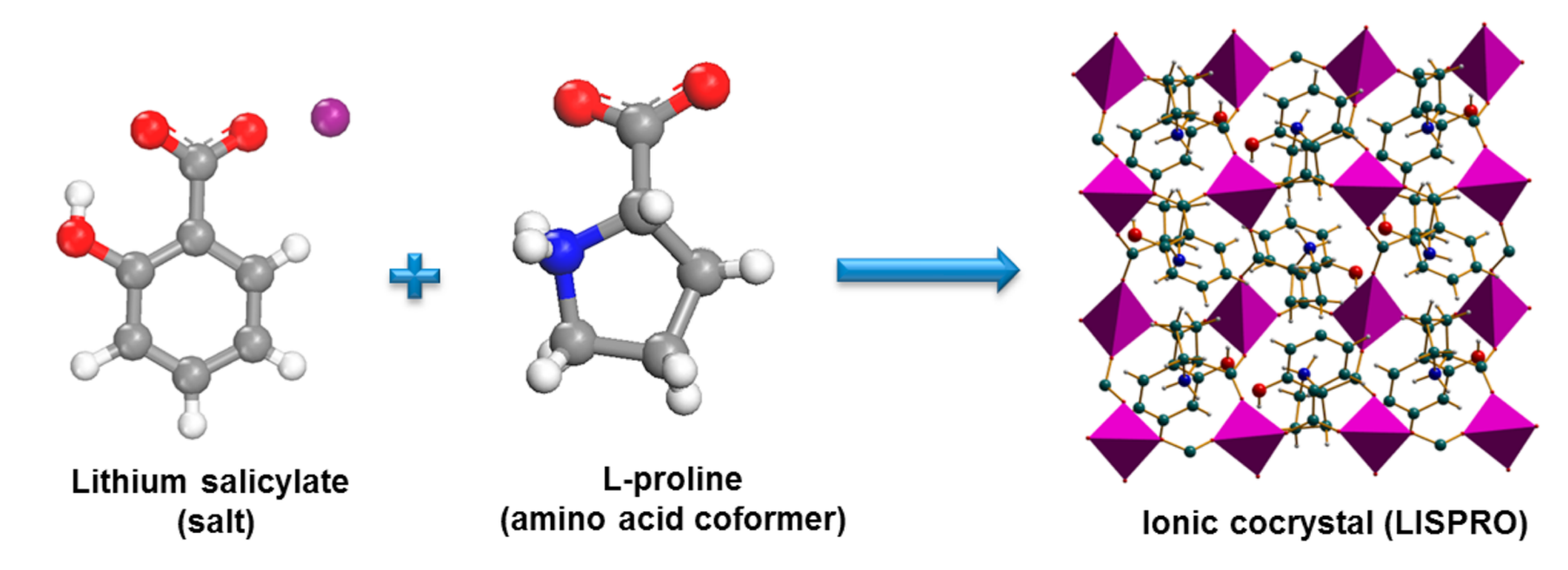
在Nunes发表研究的同时,美国南佛罗里达大学(University of South Florida)的Douglas Ronald Shytle和Jun Tan正在合作研究药物共晶技术。药物共晶技术能够改变药物的溶出特征,改善药物的体内药物动力学特性。在Nunes发表微量锂剂试验不久,Shytle和Tan开始转向开发共晶锂盐。希望利用共晶锂盐提供更加恒定的血锂浓度,方便预测药物剂量和不良反之间的联系,来实现避免血锂监测。
2013他们利用水杨酸锂和L-脯氨酸开发出一种新的共晶锂盐,命名为 LISPRO。4mEq/kg锂元素单剂量动物实验显示锂在血液和脑组织的生物利用度,LISPRO分别是常规锂剂碳酸锂的39%和56%。在血锂浓度以及脑锂浓度方面, LISPRO与碳酸锂相比都表现得更为稳定(Adam J Smith et., 2013)。
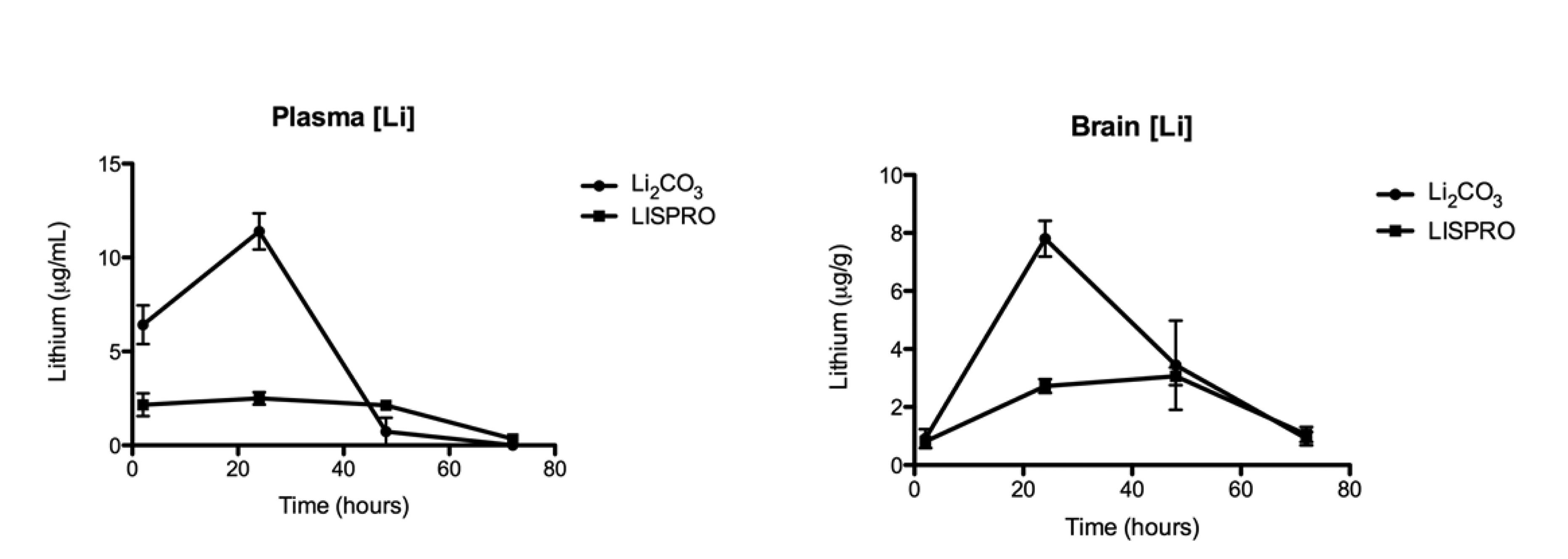
2017年Shytle和Tan发表的多剂量动物实验显示持续给药2周后LISPRO可缓慢爬升至与碳酸锂相似的血锂浓度,在脑组织中LISPRO脑锂浓度可缓慢爬升并超过碳酸锂的脑锂浓度。该项试验同时显示使用2.25 mM/kg/天的LISPRO将脑锂浓度控制在0.25–0.50 mM,在28周后LISPRO组与对空白对照组相比可显著降低阿尔茨海默症模型鼠β淀粉样蛋白和tau蛋白(Ahsan Habib et al., 2017)。注:2021年由于发现重复用图,该篇论文被编辑撤回。
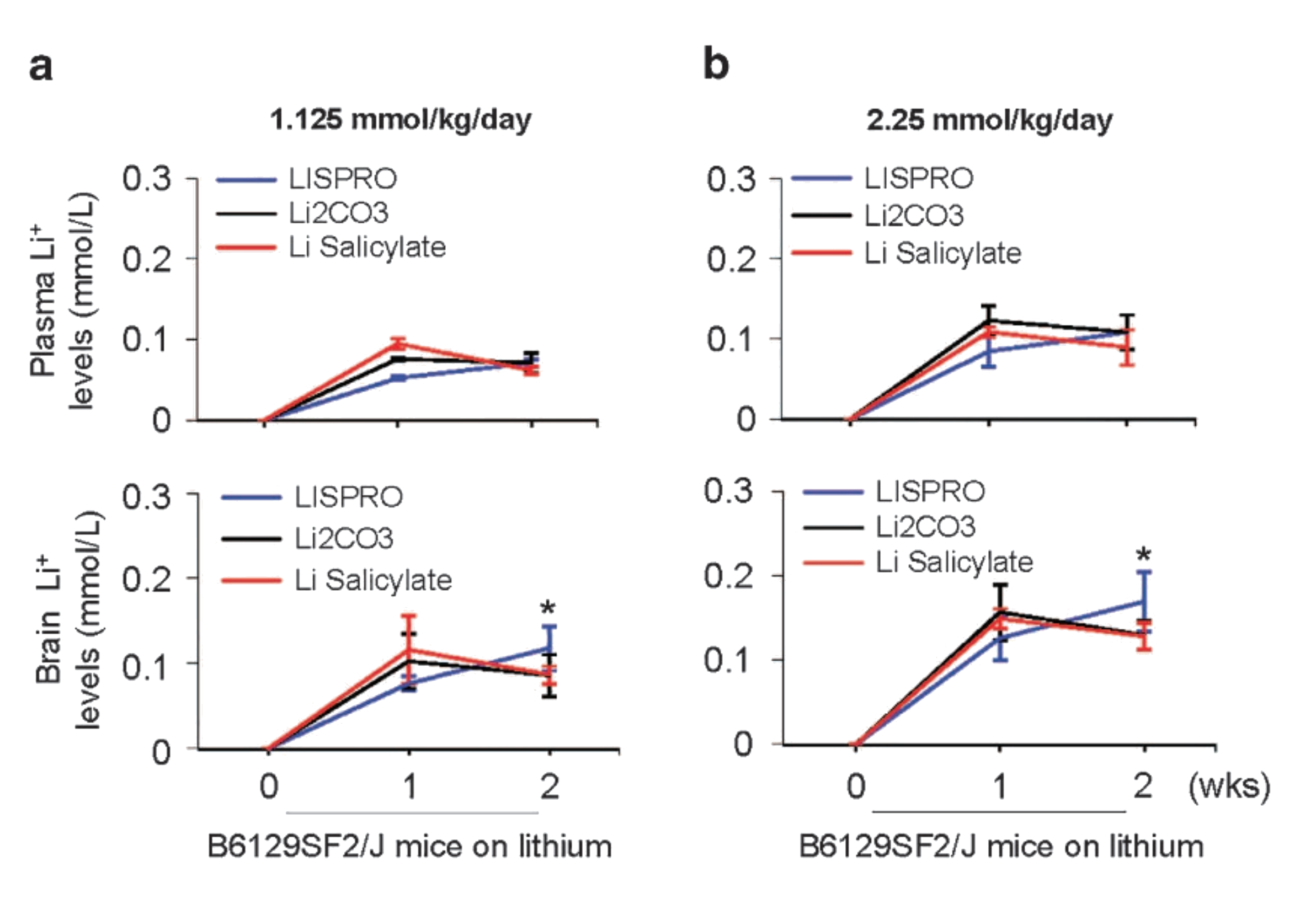
2019年Shytle和Tan发表了LISPRO对认知行为影响的试验结果。结果显示使用2.25 mmol/kg/天的LISPRO 治疗9个月后,与对照组相比可显著改善阿尔茨海默症模型鼠的认知功能(Habib A et al., 2019)。
2018年10月29日Alzamend公司发布公告宣布从佛罗里达大学获得LiProSal(LISPRO)的商业开发权力(Alzamend., 2018)。2022年3月28日Alzamend公布了AL001(LISPRO)的1期临床试验结果。单剂量人体试验显示150mg的LISPRO的血锂浓度与300mg碳酸锂相当(Alzamend., 2022)。 2023年6月22日Alzamend公布了LISPRO的2a期人体多剂量研究结果。研究显示人体可耐受240mg(相当300mg碳酸锂)一天三次剂量的AL001(Alzamend., 2023),有望成为一种不需要监测血锂浓度的抗阿尔茨海默症药物。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

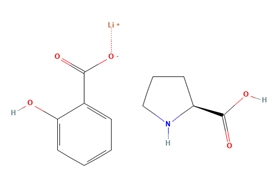
锂剂517
横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3