来源:强生 1186
2025年2月25日,强生Johnson & Johnson宣布古塞奇尤单抗(Guselkumab)注射液(静脉输注,特诺雅达®)和古塞奇尤单抗注射液(特诺雅®)已在国内获得批准,用于对传统治疗或生物制剂应答不充分、失应答或不耐受的成人中度至重度活动性克罗恩病。

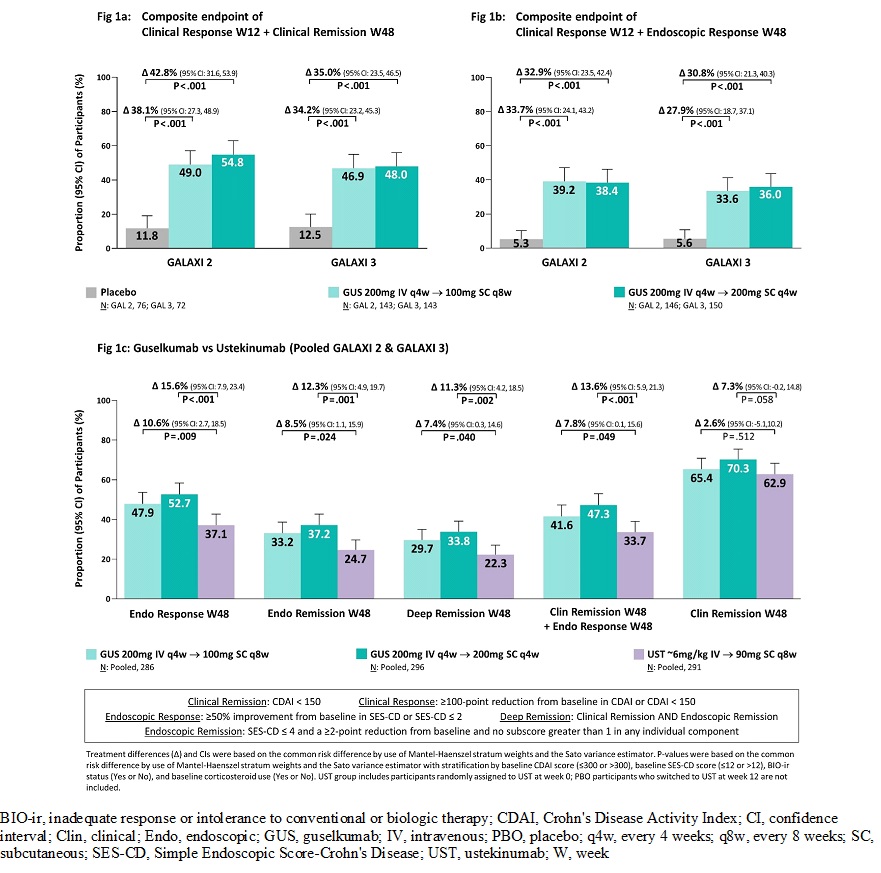
此次获批是基于古塞奇尤单抗3期临床研究GALAXI 2和GALAXI 3的研究数据。GALAXI 2和GALAXI 3分别纳入508 和513名对传统治疗或生物制剂应答不充分、失应答或不耐受的成人中度至重度活动性克罗恩病患者,按2:2:2:1比例随机接受古塞奇尤单抗200mg 静脉注射(IV),每4周一次后,共3次后转为200mg,每4周一次,皮下注射维持治疗,或转为100mg,,每8周一次维持治疗,或接受乌司奴单抗(Ustekinumab)6mg/kg静脉注射8周后改为90mg,每8周一次,皮下注射维持治疗,或安慰剂。安慰剂组无临床应答患者从第12周,转为乌司奴单抗治疗。至第12周GALAXI 2和GALAXI 3研究古塞奇尤单抗组和安慰剂组的临床缓解率率分别为47.1%和 22.4%(差异25.1%)及47.1%和15.3%(差异31.2%),内窥镜应用答率分别为37.7% 和10.5%(差异27.7%)及36.2% 和13.9%(差异22.1%)。与安慰剂组相比,古塞奇尤单抗组在复合终点上具有统计学显著差异(P均< .001)。对两个试验的汇总分析显示,古塞奇尤单抗100mg和200mg维持治疗组与乌司奴单抗组相比内镜应答率分别增加10.6%和15.6%。内镜缓解率分别增加8.5%和12.3%。深度缓解率分别增加7.4%和11.3%。在临床缓解和内镜应答复合指标方面分别增加7.8%和13.6%。在48周治疗期间内,古塞奇尤单抗组≥1例的不良事件、≥1例的严重不良事件、由于不良事件导致停药的情况及感染的发生情况与安慰剂组和乌司奴单抗组相似(Remo Panaccione., 2024)。
古塞奇尤单抗为抗白介素-23(IL-23)单克隆抗体。乌司奴单抗为抗IL-23/IL-12单克隆抗体,通过作用于IL-23和IL-12的p40亚基发挥作用。IL-23在炎症性肠病中被认为比IL-12重要。


免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。


2025年2月25日,强生Johnson & Johnson宣布古塞奇尤单抗(Guselkumab)注射液(静脉输注,特诺雅达®)和古塞奇尤单抗注射液(特诺雅®)已在国内获得批准,用于对传统治疗或生物制剂应答不充分、…
发布日期:2025-02-25 浏览数:1185
横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3