
司普奇拜单抗是靶向白介素4受体α亚基(IL-4Rα)人源化单克隆抗体,通过靶向IL-4Rα,双重阻断白介素4 (IL-4)及白介素13(IL-13)引发的炎症反应。
结构:

介绍:
司普奇拜单抗(Stapokibart,商品名:康悦达;研发代号:CM310)是康诺亚开发靶向IL-4Rα的抗IL-4Rα单克隆抗体。
司普奇拜单抗阻断 IL-4与IL-4Rα结合的IC50为0.40 nM,而度普利尤单抗(Dupilumab)为0.45 nM(Wei Liu., 2024)。
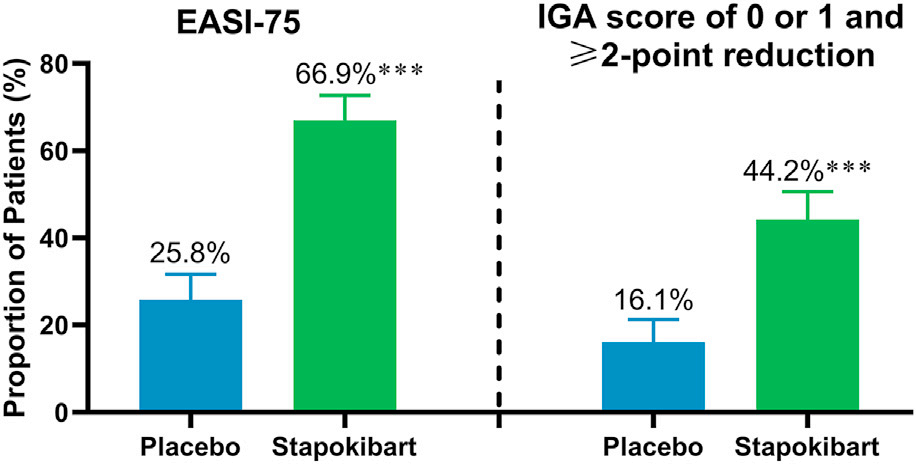
2024年,Yan Zhao等人发表司普奇拜单抗成人中度至重度特应性皮炎3期临床试验的研究结果。该试验为多中心、随机、双盲、安慰剂对照的3期临床试验,共纳入国内59个中心,500名患者,按1:1接受司普奇拜单抗300mg(负荷剂量600mg)或安慰剂,每2周一次,共16周。至第16周司普奇拜单抗和安慰剂组湿疹面积和严重程度指数评分较基线改善达到75%(EASI-75)的比例分别为66.9%和25.8%(P< .0001),研究者整体评分(IGA)为0-1分及研究者整体评分(IGA)改善≥2分的比例分别44.2%和16.1%(P< .0001)。司普奇拜单抗和安慰剂组治疗期间不良事件(TEAE)的比例分别为71.3%和66.3%。大多数不良事件为轻至中度。司普奇拜单抗和安慰剂组各有1.2%的患者发生严重不良事件,被认为与研究药物无关(Yan Zhao., 2024)。
2024年9月12日,康诺亚宣布康悦达®(司普奇拜单抗注射液)已获得国家药品监督管理局批准用于治疗成人中重度特应性皮炎(康诺亚., 2024)。
2024年10月25日,《Allergy》在线发表司普奇拜单抗用于治疗成人中重度特应性皮炎的3期临床研究52周有效性与安全性数据。在该3期临床研究中,500例中重度特应性皮炎患按1:1随机分配至300mg司普奇拜单抗组(首剂:600mg)或安慰剂组,每两周给药一次,治疗16周(双盲治疗期)。随后所有受试者均接受300mg司普奇拜单抗治疗(安慰剂转司普奇拜单抗首剂:600mg),每两周给药一次,治疗36周(维持治疗期)。至第52周,司普奇拜单抗持续治疗组和安慰剂转换为司普奇拜单抗治疗组达到湿疹面积和严重指数程度改善75%以上(EASI-75)的比例分别为92.5%和88.7%。研究者整体评估量表(IGA)》评分为为0-1分且平均较基线改善≥2分的比例分别为67.3%和64.2%。每日峰值瘙痒数字评估量表(PP-NRS)周平均值较基线改善≥4分比例分别为67.3%和60.5%。在52周治疗期间共88.1%的患者发生不良事件,大多数为轻中度(Yan Zhao)。
2024年12月23日,康诺亚宣布康悦达®(司普奇拜单抗注射液)获得国家药品监督管理局(NMPA)批准,用于治疗慢性鼻窦炎伴鼻息肉(康诺亚., 2024)。
2025年2月7日,康诺亚宣布康悦达®(司普奇拜单抗注射液)获国家药品监督管理局批准用于治疗季节性过敏性鼻炎(SAR)(康诺亚., 2025)。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3