来源:罗氏 620
2025年3月2日,罗氏Roche公布了奥马珠单抗用于儿童和成人食物过敏3期临床试验OUtMATCH研究第2阶段和第3阶段的的研究数据。

第2阶段研究结果显示,奥马珠单抗单药治疗组可以耐受至少2,000mg的花生蛋白(约8颗花生)和其他两种食物过敏原不出现过敏反应的比例为36%,而口服免疫制剂组的比例为19%(OR=2.6, p=0.031)。在安全性方面,奥马珠单抗组和口服免疫制剂组严重不良事件的发生率分别为0%和30.5%。导致研究中断的比例分别为0%和22%,接受肾上腺素紧急治疗的比例为6.9%和 37.3%。第3阶段初步研究数据显示,停止奥马珠单抗治疗后,在12个月的随访期内,61-70%的患者能够接受牛奶、鸡蛋和小麦致敏饮食,38-56%患者能够接受花生和坚果致敏饮食。
OUtMATCH为多中心、随机、双盲、安慰剂对照研3期临床试验,共分为3个阶段。第一 阶段共纳入180名受试者,按2:1随机接受奥马珠单抗或安慰剂治疗16-20周,然后在受控环境接受盲法食物激发试验。第一阶段研究结束后,117受试者进入第二阶段,受试者先接受奥马珠单抗联合口服免疫制剂治疗8周,然后按1:1比例随机接受奥马珠单抗+安慰剂或口服免疫制剂+安慰剂治疗44周。第一阶段的头60名受试者进入第3阶段,受试者接受奥马珠单抗治疗24周,然后停药。
第一阶段的研究结果已经发表,结果显示奥马珠单抗组可以耐受至少600 mg花生蛋白比例为67%,安慰剂组为7%(P<0.001)(Robert A Wood., 2024)。
奥马珠单抗(Omalizumab)为抗IgE单克隆抗体。2024年2月,基于OUtMATCH第一阶段的研究结果,FDA批准奥马珠单抗(Xolair)用于成人和儿童患者意外接触一种或多种食物后,由IgE介导的过敏反应。


免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。


2024年12月13日,爱科诺生物宣布其RIPK2 抑制剂AC-101治疗溃疡性结肠炎(UC)2期临床试验的IND申请已获得美国FDA批准。
发布日期:2024-12-13 浏览数:734

2025年3月2日,罗氏Roche公布了奥马珠单抗用于儿童和成人食物过敏3期临床试验OUtMATCH研究第2阶段和第3阶段的的研究数据。
发布日期:2025-03-02 浏览数:619

2025年4月9日,荣昌生物宣布在美国神经病学学会(AAN)年会期间,以口头报道形式发布泰它西普用于全身型重症肌无力(gMG)3期临床试验的研究结果。
发布日期:2025-04-09 浏览数:512
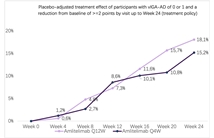
2025年9月4日,赛诺菲Sanofi宣布其靶点OX40L单克隆抗体Amlitelimab用于特应性皮炎(AD)的成人和青少年3期临床试验COAST 1达到所有主要和关键次要终点。
发布日期:2025-09-04 浏览数:466
横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3