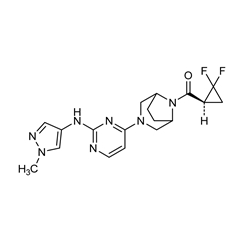
Brepocitinib是选择性选择性抑制TYK2和JAK1抑制剂,实现免疫抑制的同时,对于JAK2的选择性差,可以避免出现血红蛋白降低等副作用。
结构:
介绍:
Brepocitinib(研发编号PF-06700841)是由辉瑞Pfizer开发能够Janus激酶(JAK)选择性抑制剂。2020年6月辉瑞在线宣布与Roivant共同成立Priovant Therapeutics,以推进Brepocitinib在皮肌炎和系统性红斑狼疮等自身免疫性疾病的开发。辉瑞持有Priovant 25%的股权(Pfizer., 2022)。
JAK-STAT信号通路参与到炎症因子引起的生物效应,抑制JAK功能可实现免疫抑制。Brepocitinib选择性抑制TYK2和JAK1抑制剂,除TYK2和JAK1之外,JAK家族还包括JAK2和JAK3。抑制JAK2能够阻止促红细胞生成素(EPO)等细胞因子发挥作用,导致血红蛋白降低等副作用。因此,Brepocitinib的开发主要目的基于筛选对于JAK2的选择性差的JAK选择性抑制剂。
在含有2,4-二氨基嘧啶结构化合物基础上,辉瑞筛选出含有2,4-二氮杂二环[2.2.1]辛烷结构的化合物(8)。当三磷酸腺苷(ATP)在各酶Km浓度下,8抑制TYK2的IC50为23nM,抑制JAK2的IC50为366nM,表现出TYK2选择性高于JAK2的性质。8的对映异构体9,活性大幅下降。去掉8二环中的亚甲基桥,改为哌嗪结构(10),活性明显下降,说明亚甲桥结构在维持构象发挥重要作用(Andrew Fensome., 2018)。
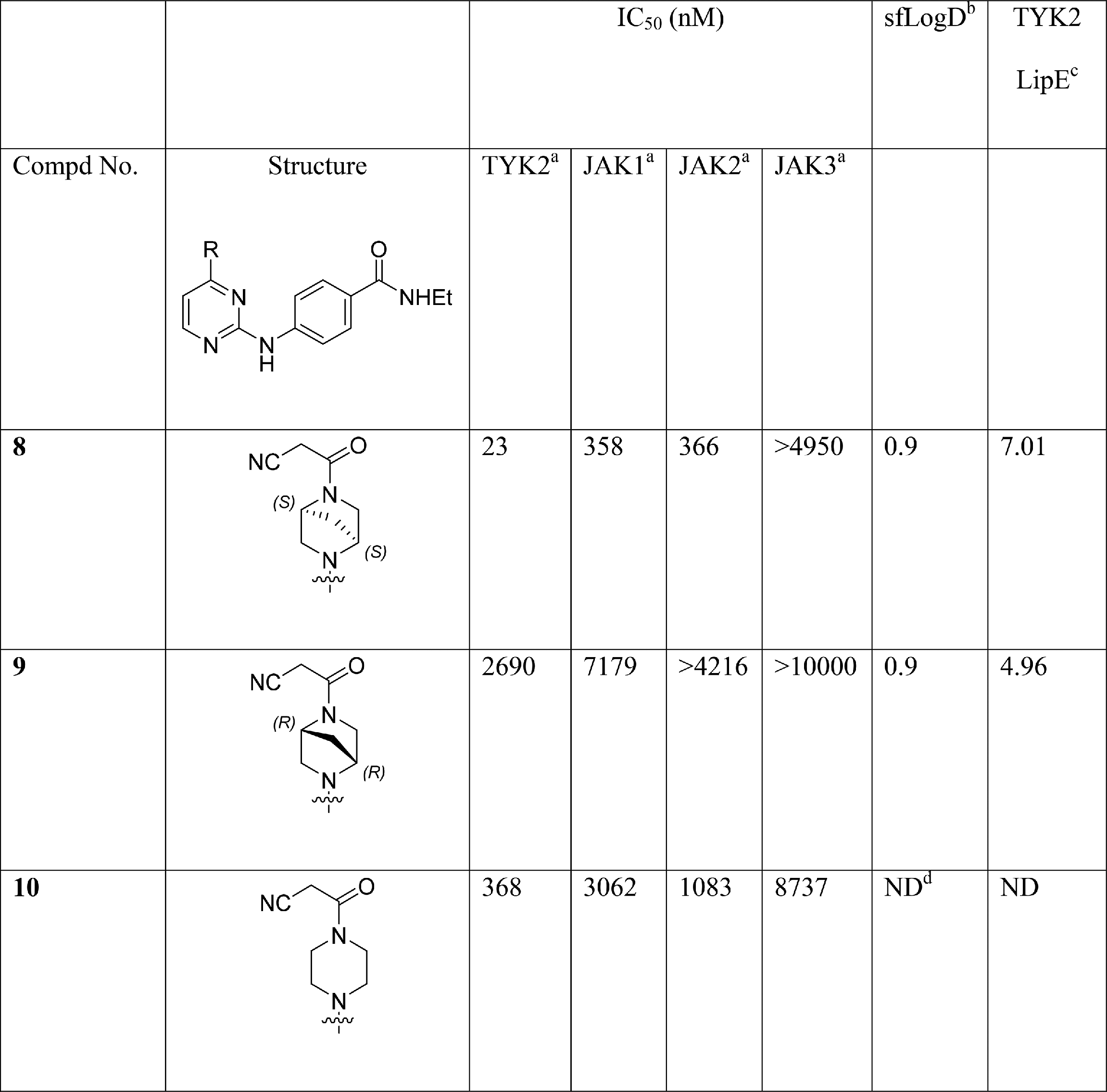
aCompounds were assayed at least twice, and the IC50 reported as the geometric mean. ATP concentration at the apparent Km for each kinase. bShake-flask LogD measured between octanol/water phosphate buffered to pH 7.4. cLipE = pIC50 − LogD. dND = Not Determined.
使用环丙基酰胺替换8结构中的氰基乙酰胺,得到与8具有有类似效力的11(在1 mM浓度ATP下11抑制TYK2的IC50为1738nM,8的IC50为774nM)。将8二环中的亚甲基桥改为亚乙基桥(12),或改变亚甲基桥结合位置(13),对于TYK2的活性大幅增强。将13的亚甲基桥改为亚乙基桥,得到对于TYK2活性更强的14。14对于JAK1也具有适度的活性,对JAK2和JAK3的选择性差。将14嘧啶还5位用F替代(15),稍稍增加了对于TYK2的活性,但造成亲脂性(sfLogD)增加,使亲脂性效率(LipE)降低,因此尽管在15的基础上继续进行后续构效研究,但F取代本身最终被放弃 。

| compd no. | IC50 (nM) | sfLogDb | LipEc | |||
| TYK2a | JAK1a | JAK2a | JAK3a | |||
| 11 | 1738 | >9524 | >10 000 | >10 000 | 1.96 | 4.10 |
| 12 | 148 | 748 | 2782 | >10 000 | 2.16 | 4.97 |
| 13 | 201 | 3473 | 7851 | >10 000 | 2.15 | 4.85 |
| 14 | 32 | 122 | 329 | >10 000 | 1.86 | 5.94 |
| 15 | 19 | 63 | 306 | 3078 | 2.88 | NDd |
aCompounds were assayed at least twice, and the IC50 was reported as the geometric mean. ATP concentration = 1 mM. bShake-flask LogD measured between octanol/water phosphate buffered to pH 7.4. cLipE = pIC50 − LogD. dND = not determined.
将15右侧苯酰胺结构中苯环改为2-吡啶环,活性大幅降(19)。在吡啶环3位上增加甲基,活性得以恢复(18)。将15右侧苯酰胺结构改为吡唑衍生物结构,并进一步筛选得到16和17。利用人全血(HWB)使用干扰素(IFN)α测试药物活性显示,16和17的活性强于18。16的羟基存在Ⅱ相代谢风险,与16相比,17增加了亲脂性(sfLogD),使亲脂性效率(LipE)降低。
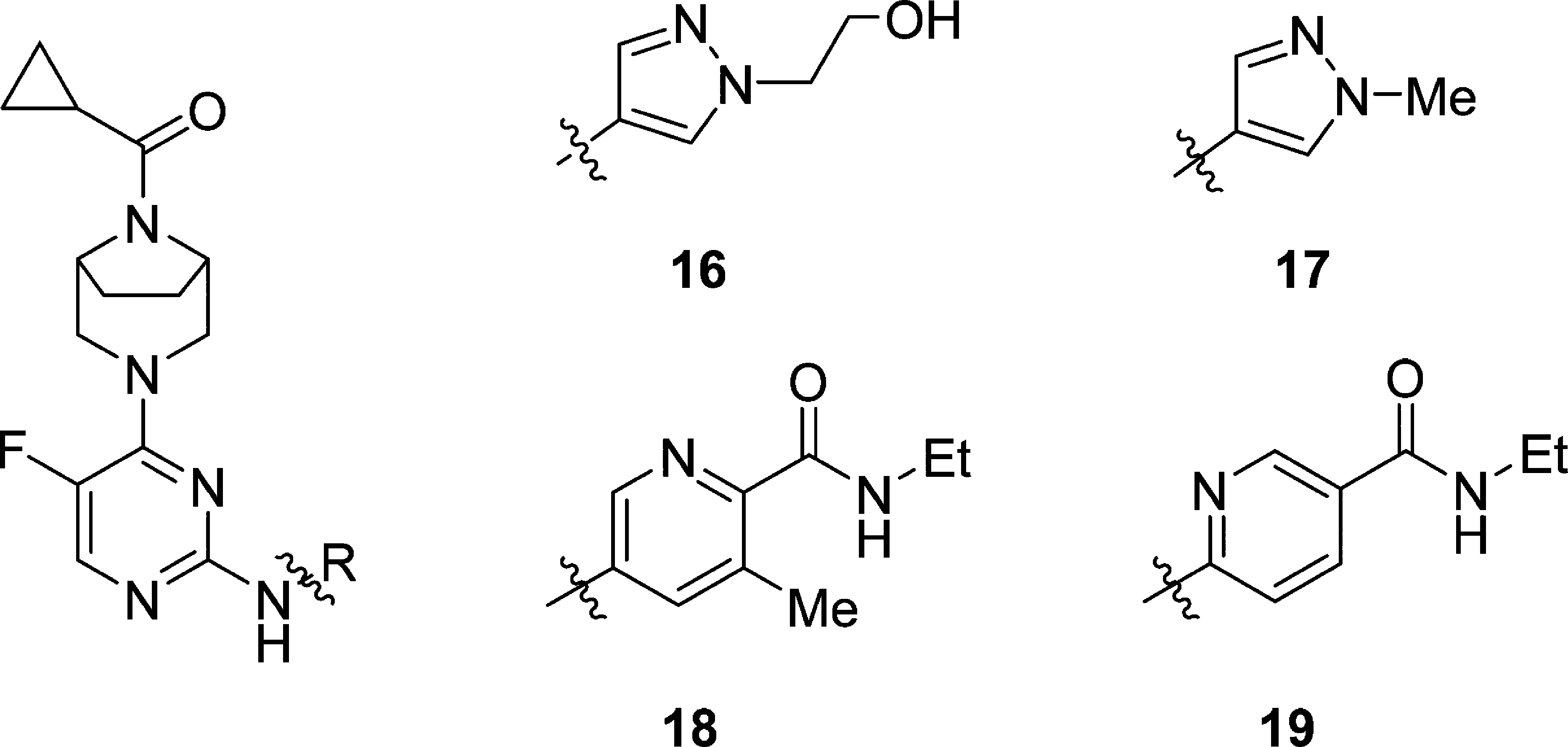
| compd no. | IC50 (nM)a | sfLogDc | LipEd | HWB IC50 (nM) (free)e | EPO ICxx* | ||||
| TYK2b | JAK1b | JAK2b | JAK3b | IFNαb | EPOb | ||||
| 16 | 55 | 81 | 260 | 2531 | 1.78 | 5.78 | 75 (70) | 2,596 | 10 |
| 17 | 53 | 76 | 488 | 2878 | 2.13 | 5.45 | 144 (84) | 6,285 | 8 |
| 18 | 48 | 234 | 692 | 4962 | 3.21 | 4.41 | 385 (91) | 12,166 | 11 |
| 19 | 7202 | >10 000 | >10 000 | >10 000 | 2.71 | 2.73 | NDf | ND | ND |
aATP concentration = 1 mM. bCompounds were assayed at least twice, and the IC50 reported as the geometric mean. cShake-flask LogD measured between octanol/water phosphate buffered to pH 7.4. dLipE = pIC50 − LogD. eFree IC50 = (IFNα HWB IC50 * human plasma free fraction)/ human red blood cell to plasma ratio. fND = not determined.
放弃17结构中F取代基,降低亲脂性得到24。将24的环丙基结构改为脲衍生物结构得到20、21和22。尽管20的活性最强,由于具有较高的极性,HWB IFNα检测显示,活性低于21。在24的环丙基结构上引入F取代基,得到23(PF-06700841)。23与21活性相似,亲脂性降低(sfLogD),使亲脂性效率(LipE)增加。23对于TYK2a和JAK1a抑制作用(IC50)远小于JAK2,几乎不影响JAK3。HWB检测对于IFNα的抑制作用远小于EPO,对于EPO的选择性(EPO ICxx*)为18,不超过预设边界。此处还对24的对映异构25进行了研究,实验显示25的活性大幅下降。
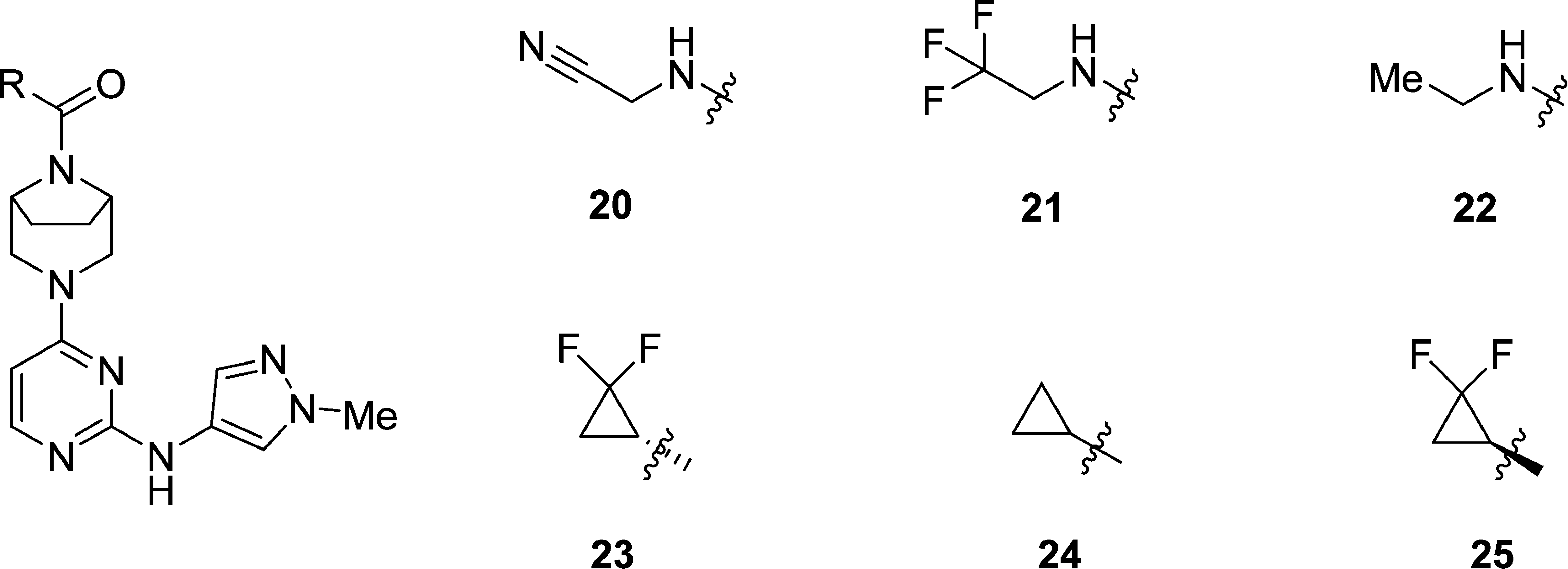

| compd no. | IC50 (nM) | sfLogDb | LipEc | HWB IC50 (nM) (free)d | EPO ICxx* | ||||
| TYK2a | JAK1a | JAK2a | JAK3a | IFNα | EPO | ||||
| 20 | 16 | 13 | 67 | 2477 | 0.97 | 7.13 | 120 (73)f | 1229 | 28 |
| 21 | 28 | 14 | 146 | 6872 | 1.72 | 6.13 | 51 (26) | 1160 | 15 |
| 22 | 71 | 104 | 538 | >10 000 | 1.44 | 6.01 | 116 (60) | 2866 | 14 |
| 23 | 23 | 17 | 77 | 6494 | 1.61 | 6.31 | 30 (13) | 577 | 18 |
| 24 | 76 | 199 | 684 | >10 000 | 1.52 | 5.90 | 119 (91) | 3737 | 11 |
| 25 | 702 | 842 | 3148 | >10 000 | 1.55 | 4.91 | 823 (399) | 5655 | 37 |
aCompounds were assayed at least twice, and the IC50 reported as the geometric mean. ATP concentration = 1 mM. bShake-flask LogD measured between octanol/water phosphate buffered to pH 7.4. cLipE = pIC50 − LogD. dCompounds were assayed at least twice, and the IC50 reported as the geometric mean. Free IC50 = (IFNα HWB IC50 * human plasma free fraction)/human red blood cell to plasma ratio. eICxx calculated at 10 mg BID using an unbound Cav = 83 nM.18 fFree IC50 = IFNα HWB IC50 * calculated human plasma free fraction.
治疗斑块状银屑病的2a期临床试验,使用PF-06700841(Brepocitinib)口服治疗12周。在改善患者《银屑病皮损面积和严重程度指数(PASI)》评分方面PF-06700841优于安慰剂,其中PF-06700841 30mg(QD)持续治疗组降分最大(P< 0.0001)。在治疗期间,PF-06700841治疗组189名患者中136 名患者出现不良事件,最常见的全因果关系不良事件是鼻咽炎(28/189,14.8%)、上呼吸道感染(14/189,7.4%)和头痛(14/189,7.4%)。共5 例患者发生 6 起严重不良事件,13例因不良事件而停药。无患者发生带状疱疹病例或包括血栓栓塞在内重大不良心脏事件(Seth B Forman., 2020)。
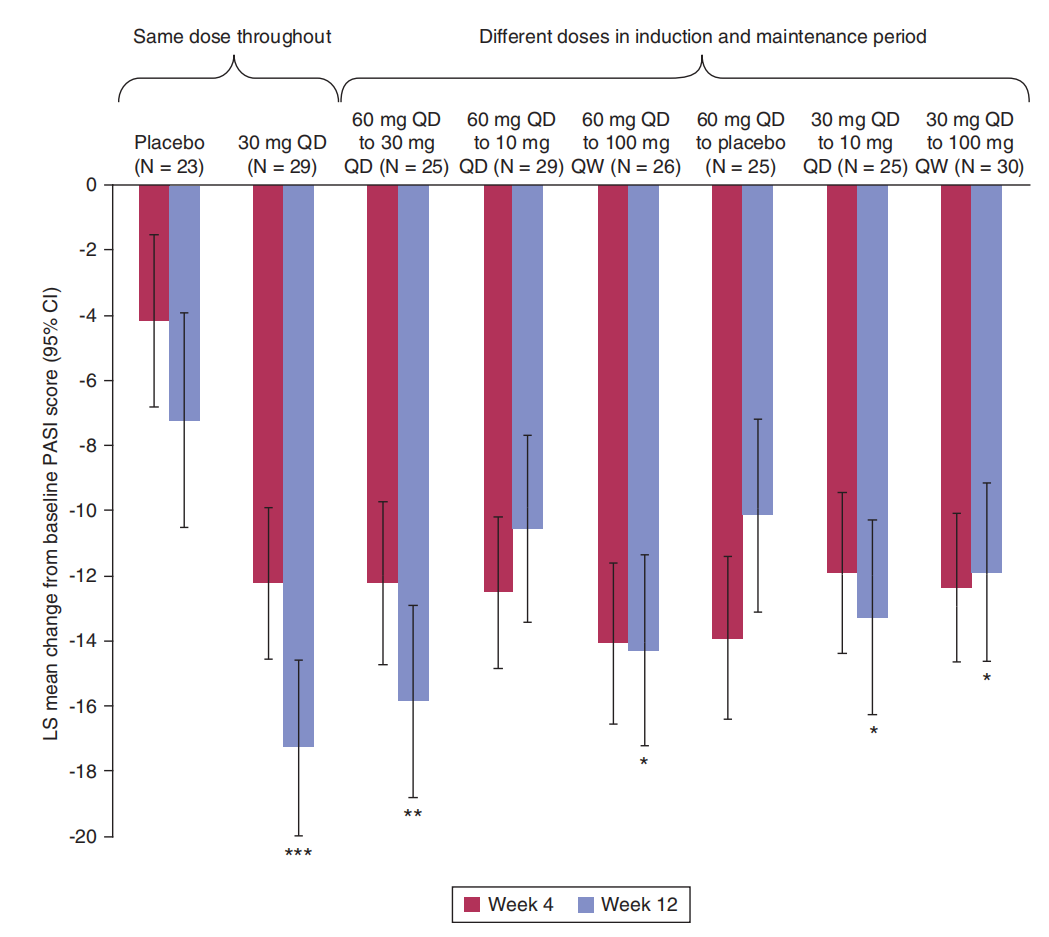
*Hochberg P-value < 0.05; **Hochberg P-value < 0.001; ***Hochberg P-value < 0.0001 versus placebo. CI, confidence interval; LS, least squares; MMRM, mixed model repeated measures; QD, once daily; QW, once weekly.
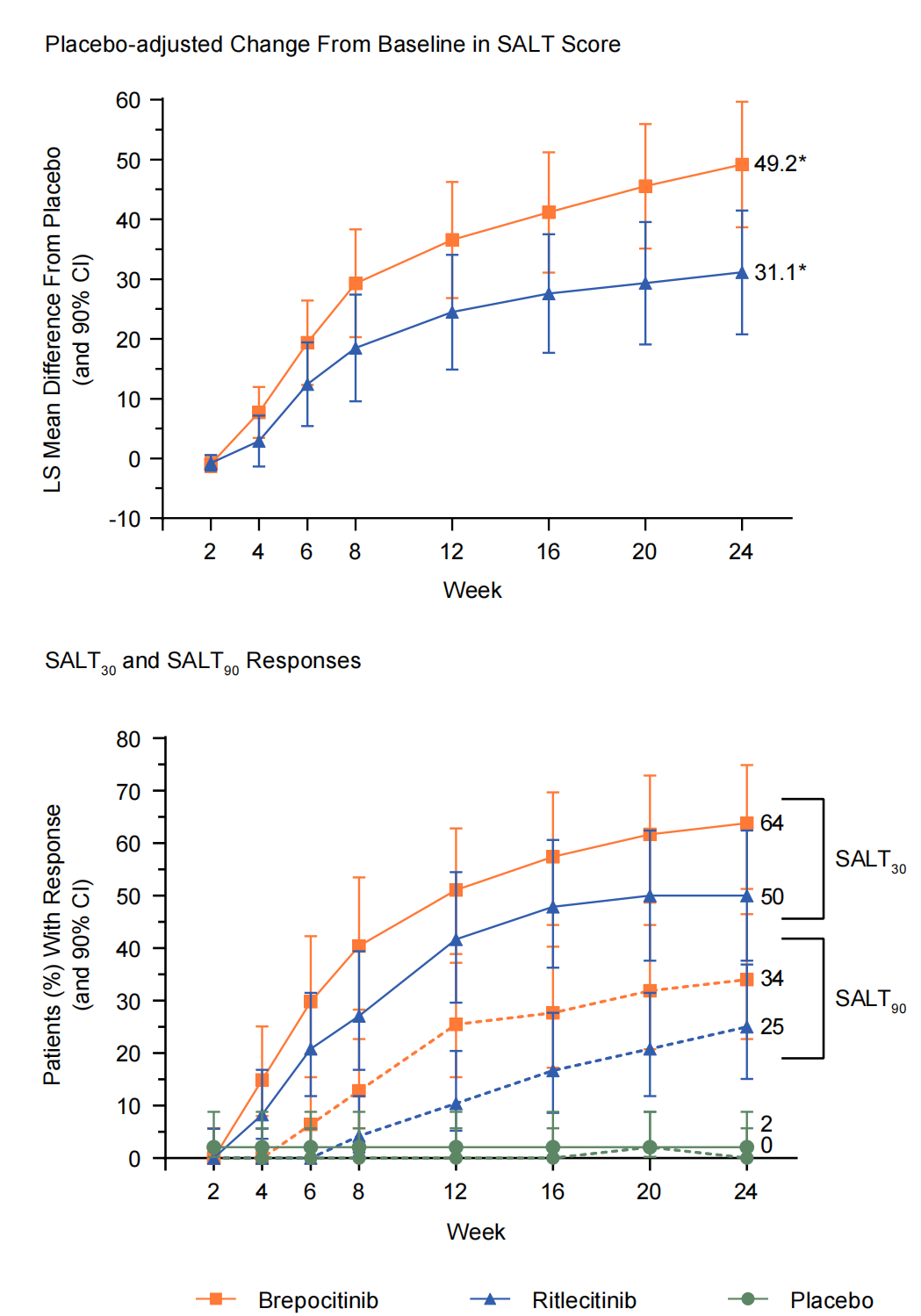
治疗斑秃的2a期临床试验,使用PF-06700841(Brepocitinib)口服治疗24周(60 mg QD,持续 4 周,然后 30 mg QD,持续 20 周)在改善《脱发严重程度工具(SALT)》评分方面显著优于利特昔替尼(Ritlecitinib:200 mg QD,持续 4 周,然后 50 mg QD,持续 20 周)与安慰剂组。安慰剂、利特昔替尼和Brepocitinib组分别有35/47(74%)、32/48(67%)和36/47(77%)例患者发生不良事件。常见的不良事件是上呼吸道感染、鼻咽炎、头痛、痤疮和恶心。无病例发生机会性感染。2例接受brepocitinib治疗的患者出现严重的横纹肌溶解,不伴有急性肾损伤,二者之前都进行了剧烈体力活动,没有出现后遗症。安慰剂、利特昔替尼和Brepocitinib组分别有3例(6%)、2例(4%)和4例(9%)由于发生不良事件,导致停药(Brett King., 2021)。
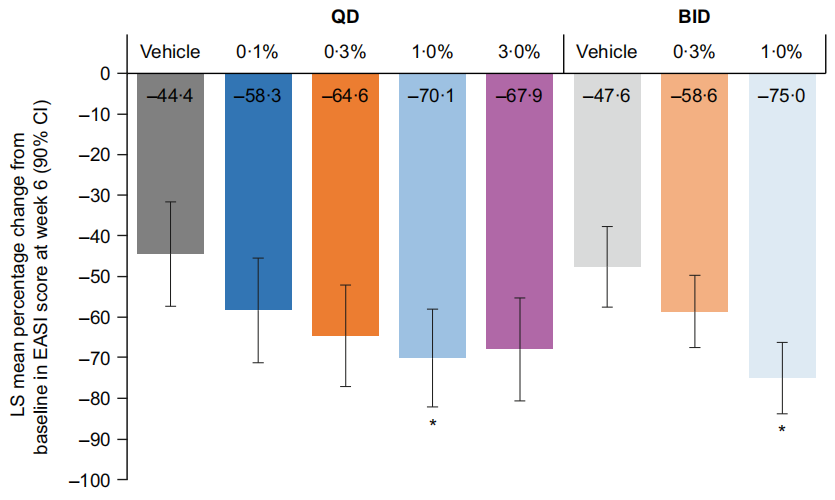
治疗轻至中度特应性皮炎的2b期临床试验,使用Brepocitinib外用治疗6周,在降低《湿疹面积及严重度指数(EASI)》评分方面,Brepocitinib 1% QD和 1% BID,分别达到70. 1(82.1-58.0)%和75.0(83.8-66.2)%,而安慰剂对照组只有 QD 44.4(57.3-31.6)%和 BID 47.6(57 5-37.7)%。292名受试者中108名患者(37.0%)在研究期间经历不良事件(TEAE)。对照组不良事件发生比例最高(47.2-48.6%)。16例患者由于不良事件停止研究,其中8例在对照组。导致停药的不良事件,最常见是特应性皮炎出现恶化,对照组8例,Brepocitinib组4例。不良事件的发生率没有剂量依赖性趋势。无受试者出现重大不良事件或死亡。两名受试者经历严重不良事件:0.3%Brepocitinib BID组一名受试者出现了治疗相关性红斑(12天后消退),BID对照组一名受试者经历治疗相关性接触性皮炎(4天后消退),两名受试者都停止参加研究(Megan N Landis., 2022)。
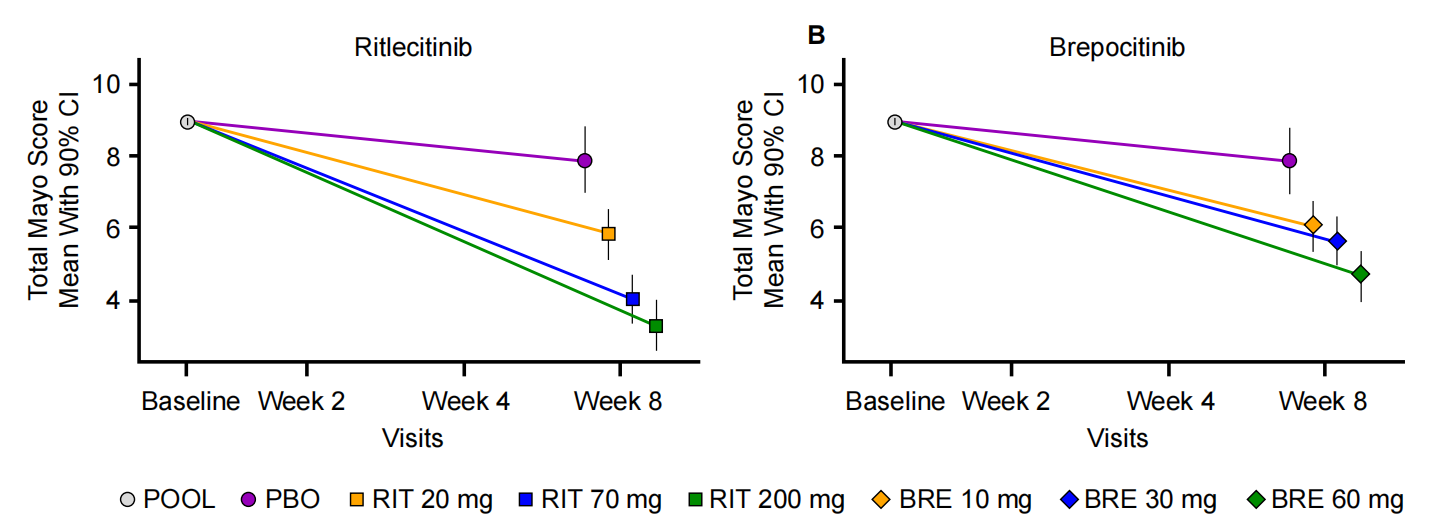
治疗中度至重度溃疡性结肠炎的2b期临床试验,使用Brepocitinib口服治疗8周,在改善总《梅奥评分》(TMS)方面,安慰剂校正后的平均TMS(90% CI)Brepocitinib 10、30和60mg组分别为降低1.8(2.9-0.7)、2.3(3.4-1.1)和3.2(4.3-2.1)。利特昔替尼(Ritlecitinib)20、70和200mg组分别降低2.0(3.2-0.9)、3.9(5.0-2.7)和4.6(5.8-3.5)。安慰剂校正后的临床治愈率Brepocitinib 10、30和60mg组分别是14.6%(1.9%-25.7%)、25.5%(11.0%-38.1%)和25.5%(11.0%-38.1%)。利特昔替尼20、70和200mg组分别是13.7%(0.5%-24.2%)、32.7%(20.2%-45.3%)和36.0%(23.6%-48.6%)。治疗期间不良事件大多为轻度,无严重带状疱疹感染病例。Brepocitinib组16.9% (12.5%–23.7%)利特昔替尼组8.7%(5.2%–13.4%) 和安慰剂 组4.0%(0.2%–17.6%)的受试者发生感染。利特昔替尼组1例患者发生心肌梗死死亡,Brepocitinib组1例患者发生血栓栓塞事件,两例都被认为与研究药物无关(William J Sandborn., 2022)。
治疗轻中度慢性斑块状银屑病的2b期临床试验,尽管显示Brepocitinib外用耐受性良好,但未见在疗效上与安慰剂相比存在显著性差异(Megan N Landis., 2023)。
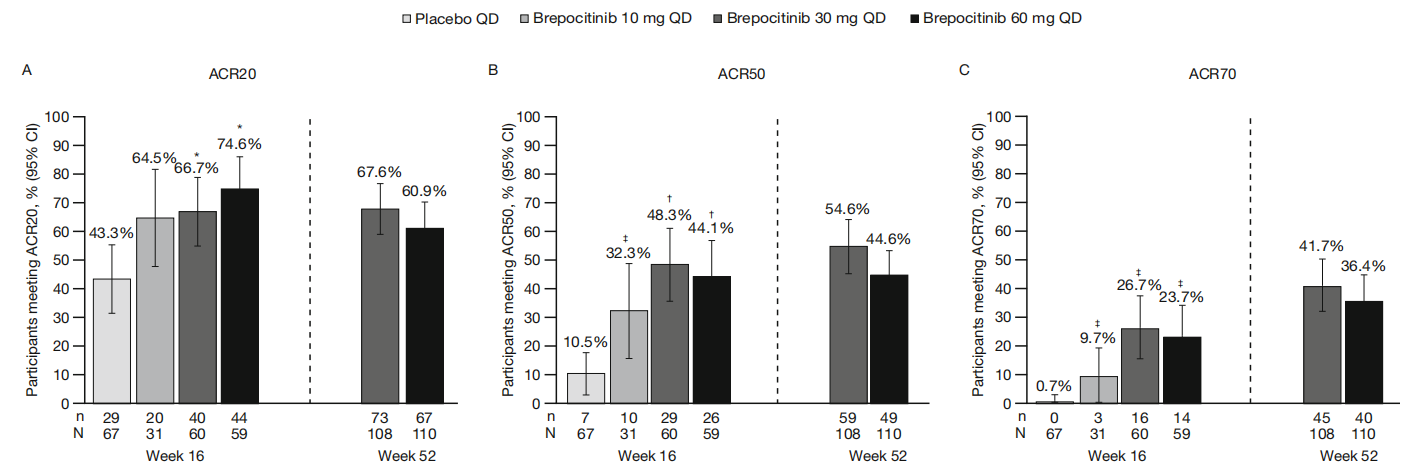
治疗活动性银屑病关节炎的2b期临床试验,使用Brepocitinib口服治疗16周(10、30、60mg QD)后剂量增加至30或60mg QD直至52周。在第16周,根据《美国风湿病学会(ACR)改善达到20%》(ACR20)标准,Brepocitinib 30和60 mg剂量组达到ACR20的比例,分别是66.7%(P = 0.0197)和74.6%(P=0.0006),显著高于安慰剂组(43.3%)。并且Brepocitinib的疗效可维持或提高至第52周。患者在试验期间经历的不良事件大多为轻度或中度。12名受试者(5.5%)发生15次严重不良事件,其中Brepocitinib 30和60 mg剂量组中,6名受试者(2.8%)发生感染。无患者发生重大不良心血管事件或死亡(Philip Mease., 2023)。
2024年4月2日Priovant Therapeutics在线公布了Brepocitinib治疗活动性非感染性葡萄膜炎(NIU)的2期临床试验NEPTUNE结果。NEPTUNE共纳入26 名活动性 NIU的受试者。按2:1接受Brepocitinib一天一次(QD)45mg 或15mg进行治疗。患者在治疗的前2周同时接受泼尼松冲击疗法,并在2周后逐渐减少泼尼松冲剂量直至第8周后停用泼尼松。在第 24 周时,Brepocitinib 45mg组和15 mg组分别有29%(5/17)和44%(4/9)的受试者符合治疗失败标准。停药检查显示Brepocitinib 45mg组疾病活动治疗失败率为18%,是非甾体药物疗法相应注册研究观察到获益的两倍。所有次要疗效终点,包括雾度、视力和黄斑厚度,在第24 周的也呈剂量相关性积极反应。Brepocitinib 45 mg组基线时达到葡萄膜性黄斑水肿阈值的患者,其中43%的患者在第24周时黄斑水肿消退。Brepocitinib 45 mg组基线时没有黄斑水肿的患者,在第24周时未出现黄斑水肿。试验显示Brepocitinib安全性和耐受性与既往Brepocitinib的临床研究一致,未出现新的安全性或耐受性方面的问题(Priovant Therapeutics., 2024)。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3