
司美格鲁肽(Semaglutide Wegovy)为FDA批准的第二个多肽类减肥药物。属于GLP-1受体激动剂,能够抑制胃和胰腺消化液的分泌以及胃的蠕动排空,减少食欲,降低体重。。
结构:
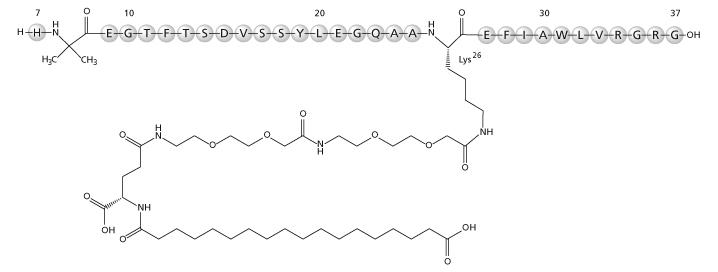
介绍:
司美格鲁肽(Semaglutide)是诺和诺德Novo Nordisk开发的长效肽类GLP-1(胰高血糖素样肽-1)激动剂类药物,一周皮下注射一次。Wegovy®是司美格鲁肽2.4mg制剂,是FDA批准的第二个多肽类减肥药物。GLP-1(胰高血糖素样肽-1)属于一种肠促胰岛素,能够葡萄糖浓度依赖性促进胰岛素分泌,发挥降糖作用。GLP-1也能够抑制胰高血糖素的分泌,从而抑制肝糖原分解。GLP-1还能够抑制胃和胰腺消化液的分泌以及胃的蠕动排空,减少食欲,降低体重。
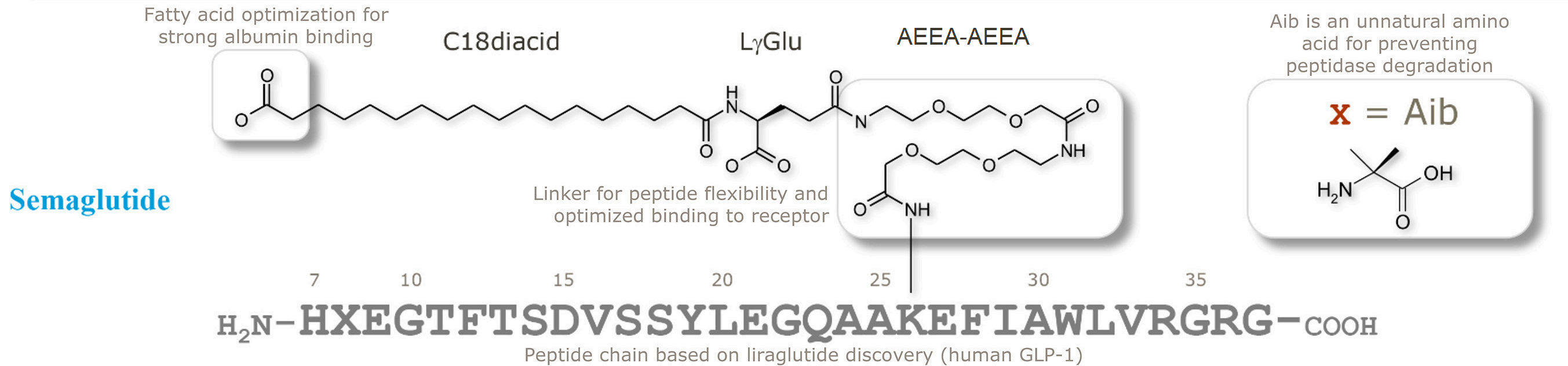
司美格鲁肽是在利拉鲁肽的基础上开发的长效的GLP-1受体激动剂。司美格鲁肽通过引入非天然氨基酸Aib、以及AEEA连接子并将脂肪酸改用二元脂肪酸后实现一周注射一次。
| 药物 | 结构 | X:Aib | |||||||||||||||||||||||||||||
|
|
7 |
|
|
10 |
|
|
|
|
15 |
|
|
|
|
20 |
|
|
|
|
25 |
|
|
|
|
30 |
|
|
|
|
|
|
|
| GLP-1(7-37) | H | A | E | G | T | F | T | S | D | V | S | S | Y | L | E | G | Q | A | A | K | E | F | I | A | W | L | V | K | G | R | G |
| 利拉鲁肽 | H | A | E | G | T | F | T | S | D | V | S | S | Y | L | E | G | Q | A | A | K | E | F | I | A | W | L | V | R | G | R | G |
| K: K-γGlu-C16 Monoacid | |||||||||||||||||||||||||||||||
| 司美格鲁肽 | H | X | E | G | T | F | T | S | D | V | S | S | Y | L | E | G | Q | A | A | K | E | F | I | A | W | L | V | R | G | R | G |
| K: K-(AEEA)2-γGlu-C18 Diacid | |||||||||||||||||||||||||||||||
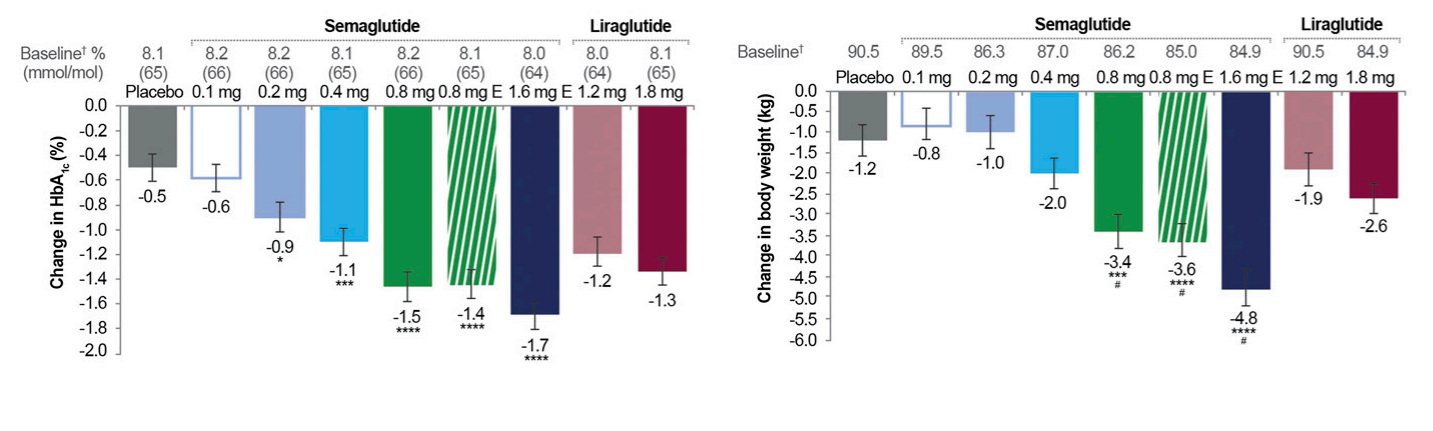
尽管司美格鲁肽的开发设计只是为延长药物的作用时间,但2期临床试验显示,无论是降低HbA1c还是减重,司美格鲁肽都优于利拉鲁肽(Michael A Nauck., 2016)。
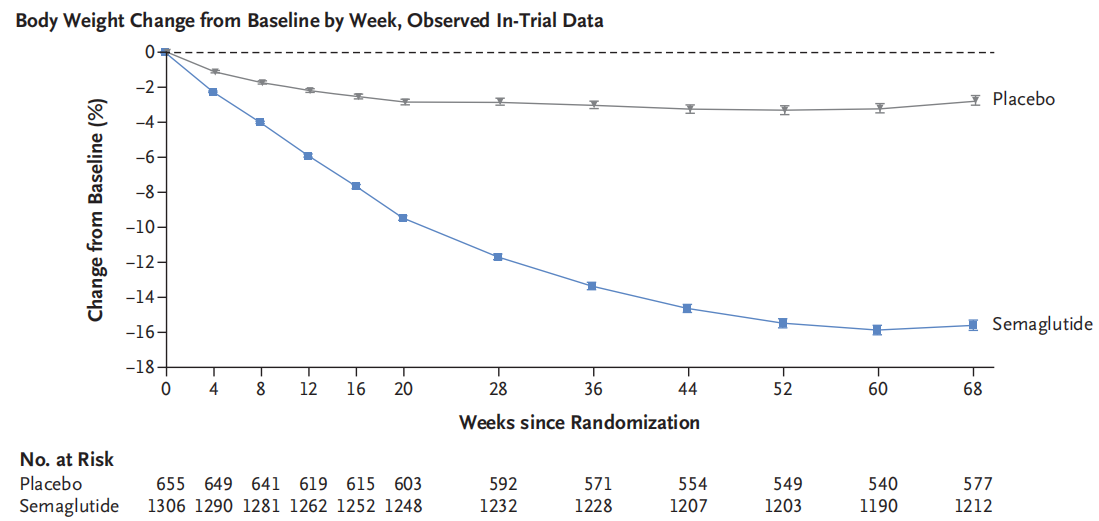
2021年3月18日《The New England Journal of Medicine》发表司美格鲁肽2.4mg用于肥胖或超重患者的3期临床研究STEP 1的试验结果。该研究共纳入1961名BMI≥30或至少伴有一种并发症BMI≥27的非糖尿症肥胖或超重患者,随机接受司美格鲁肽2.4mg或安慰剂治疗68周。至第68周,司美格鲁肽组体重平均降低14.9%,安慰剂组平均降低2.4%,司美格鲁肽与安慰剂组相比相对降低12.4 %(P<0.001)。司美格鲁肽组体重降幅≥5% 、≥10%、≥15%比例是86.4%、69.1%、50.5%,均显著(P<0.001)超过安慰剂组(31.5%、12.0%、4.9%)。司美格鲁肽组体重平均降低15.3 kg,安慰剂组平均降低2.6 kg,司美格鲁肽与安慰剂组相比相对降低12.7 kg。与安慰剂组相比,司美格鲁肽组心血管代谢疾病的风险显著降低和患者报告身体功能显著改善。在安全性方面,恶心和腹泻是司美格鲁肽最常见的不良事件,通常短暂,严重程度轻至中度,并随时间的推移逐渐消退。与比安慰剂组相比,司美格鲁肽组中有更多的患者因胃肠道事件而停止治疗(John P H Wilding., 2021)。
2021年4月13日《JAMA》发表司美格鲁肽2.4mg用于肥胖或超重患者STEP 4的试验结果。该研究共纳入803名按受司美格鲁肽组2.4mg治疗20周的肥胖或超重患者,随机接受继续接受司美格鲁肽或安慰剂治疗至第68周。在未分组前(前20周),患者体重降低平均降低10.6%。分组后(从第20周到第68周)司美格鲁肽组体重降低7.9%,而安慰剂组体重增加6.9%(P < .001)。从第0-68周司美格鲁肽组患者的累计降幅达到17.4%(Domenica Rubino., 2021)。司美格鲁肽成为第一个在临床试验中,平均减重超过15%的减肥药物。
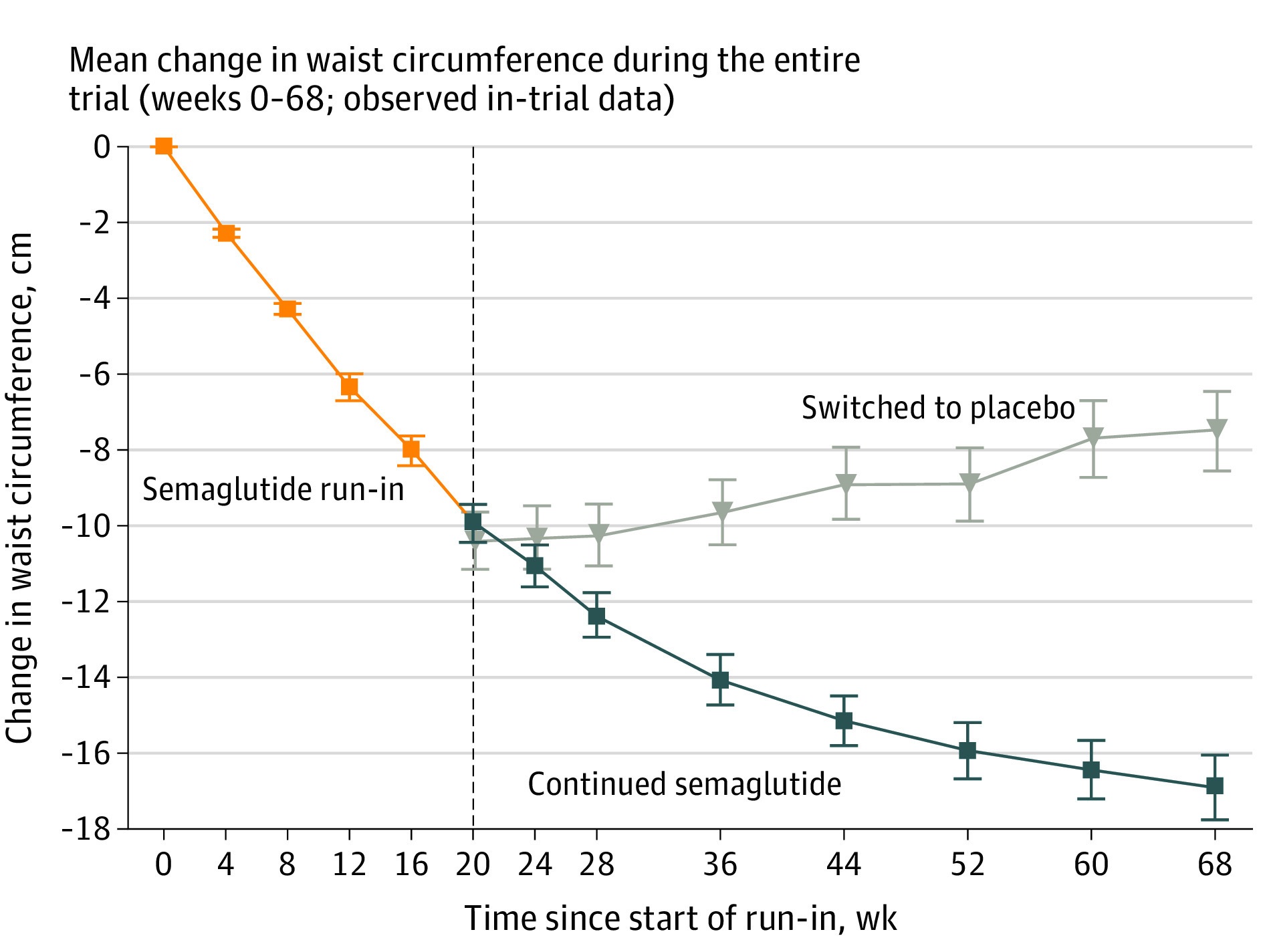
2021年6月4日FDA基于STEP 1试验结果批准了司美格鲁肽(Semaglutide)2.4mg用于治疗肥胖和超重。
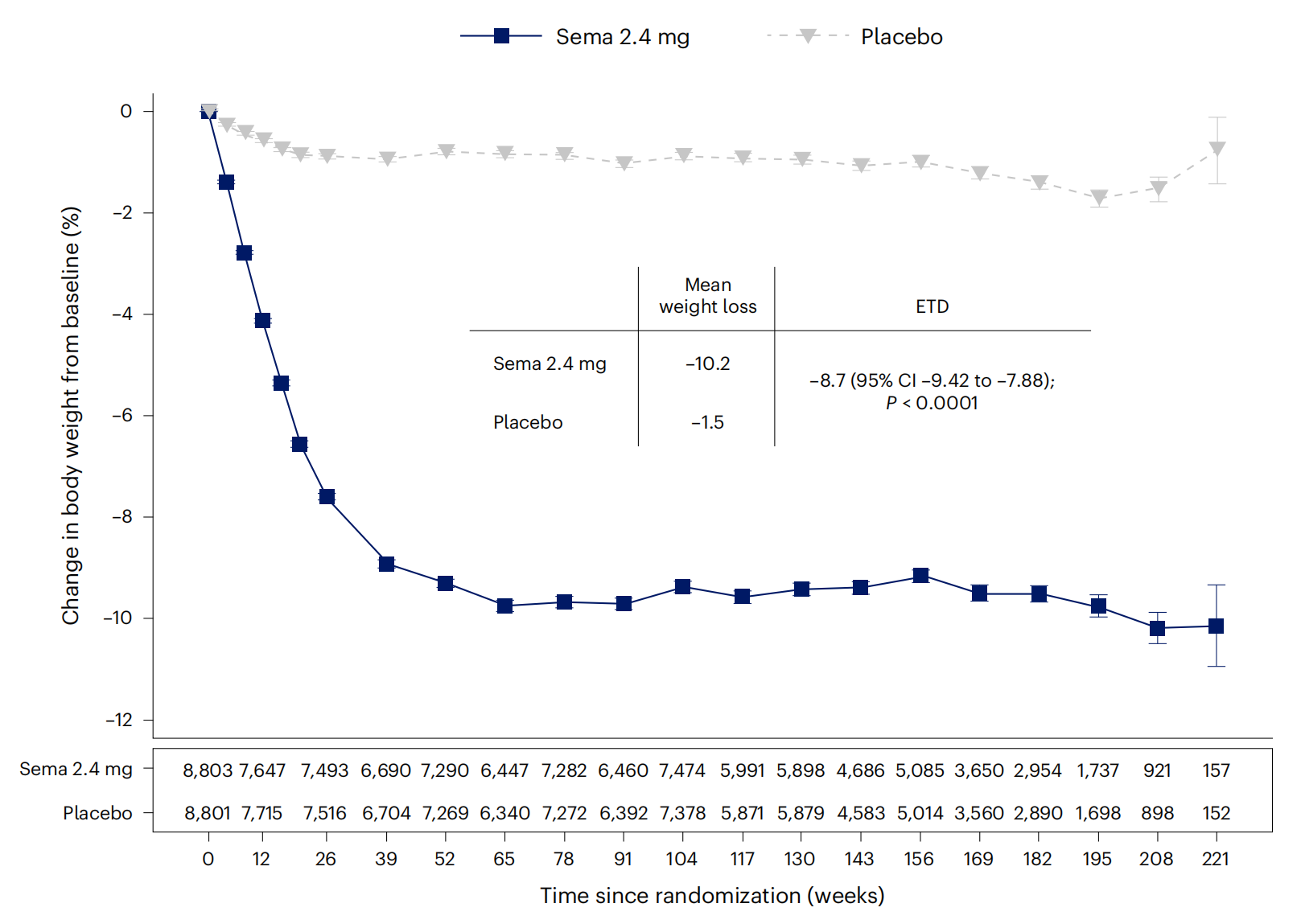
2023年11月11日《The New England Journal of Medicine(新英格兰医学杂志)》在线发表SELECT试验对心血管事件的影响结果。SELECT一项多中心、双盲、随机、安慰剂对照试验,共纳入17,604名BMI≥27kg m−2、年龄≥45、不合并糖尿病的肥胖患者。患者按1:1比例随机接受司美格鲁肽 2.4 mg /周或安慰剂进行治疗。司美格鲁肽或安慰剂的平均(±SD)持续治疗时间为34.2±13.7个月,平均随访时间为39.8±9.4个月。司美格鲁肽组8803例患者中有569例(6.5%)发生原发性心血管终点事件,安慰剂组8801例患者中有701例(8.0%)发生原发性心血管终点事件(hazard ratio, 0.80; 95% confidence interval, 0.72 to 0.90; P<0.001)。司美格鲁肽组1461例(16.6%)、安慰剂组718例(8.2%)由于不良事件导致停药(P<0.001)(A Michael Lincoff., 2023)。
2022年12月23日FDA批准减肥用司美格鲁肽2.4mg(Wegovy®)用于12岁以上儿童。
2024年3月8日FDA批准减肥用司美格鲁肽2.4mg(Wegovy®)用于降低成人肥胖或超重患者已确诊伴有心血管疾病严重心血管事件(MACE)发生风险,包括心血管疾病死亡事件、非致死性心脏病发作事件(心肌梗死)或非致死性脑卒中事件的发生风险。
2024年5月13日《Nature Medicine(自然医学)》在线发表了司美格鲁肽SELECT试验体重4年干预结果。司美格鲁肽至第65周持续降低体重,并可持续维持控制体重到第4年(208周)。至208周司美格鲁肽组体重平均降低10.2%、腰围平均降低7.7厘米和腰高比平均降低6.9%,而安慰剂组分别为1.5%、-1.3厘米-1.0%,p值均小于0.0001。司美格鲁肽组严重不良事件的发生率根据BMI(kg m−2)分别为43.23(BMI<30)、43.54(BMI≥30且<35)、51.07(BMI≥35且<40)和47.06(BMI≥40),分别低于安慰剂组50.48、49.66、52.73和60.85(Donna H Ryan., 2024)。
2024年6月25日,诺和诺德发布公告宣布国家药品监督管理局(NMPA)批准诺和盈®(司美格鲁肽注射液)中国上市申请,用于包括体重指数(BMI) ≥30kg/m2肥胖患者,以及BMI ≥27kg/m2至<30kg/m2并合并高血糖、 高血压、血脂异常、阻塞性睡眠呼吸暂停或心血管疾病等体重相关合并症超重患者的长期体重管理(诺和诺德., 2024)。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3