Danuglipron是Pfizer辉瑞使用高通量筛选(HTS)方法,配合正向变构调节剂(PAM)BETP在280万种化合物中筛选得到苗头(hit)化合物的基础上,结构不断优化得到的小分子GLP-1受体激动剂(GLP-1RA)类药物。目前已转为开发一天一次的缓释制剂。
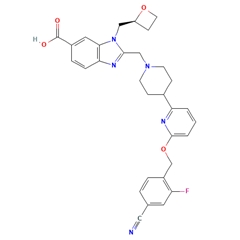
结构:
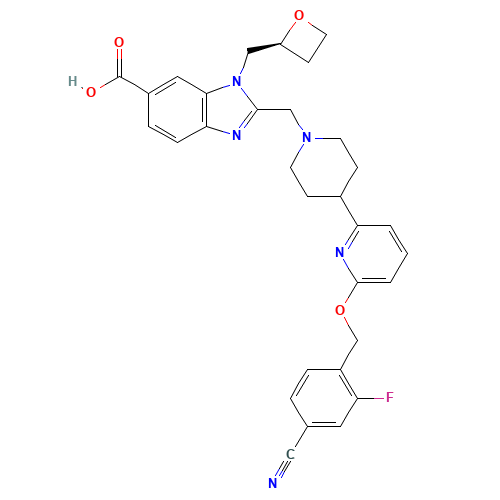
介绍:
Danuglipron(研发编号PF-06882961)是辉瑞实验室在从280万种化合物中采用高通量筛选(HTS)方法得到的苗头(hit)化合物的基础上,经结构优化开发的口服小分子GLP-1受体激动剂(GLP-1RA)类药物
在得到PF-06882961的hit化合物之前,Pfizer已经做过多次筛选,一直未找到合适的hit化合物。考虑GLP-1受体(GLP-1R)需要较高的活化能,而正向变构调节剂(PAM)有利于降低受体的活化能,因此Pfizer尝试用GLP-1R的正向变构调节剂BETP,来重新筛选hit化合物。BETP通过作用于GLP-1R第3膜内环上的半胱氨酸残基(第347位),来增强GLP-1(7-36)的弱活性代谢产物GLP-1(9-36)对于GLP-1R的激动作用。
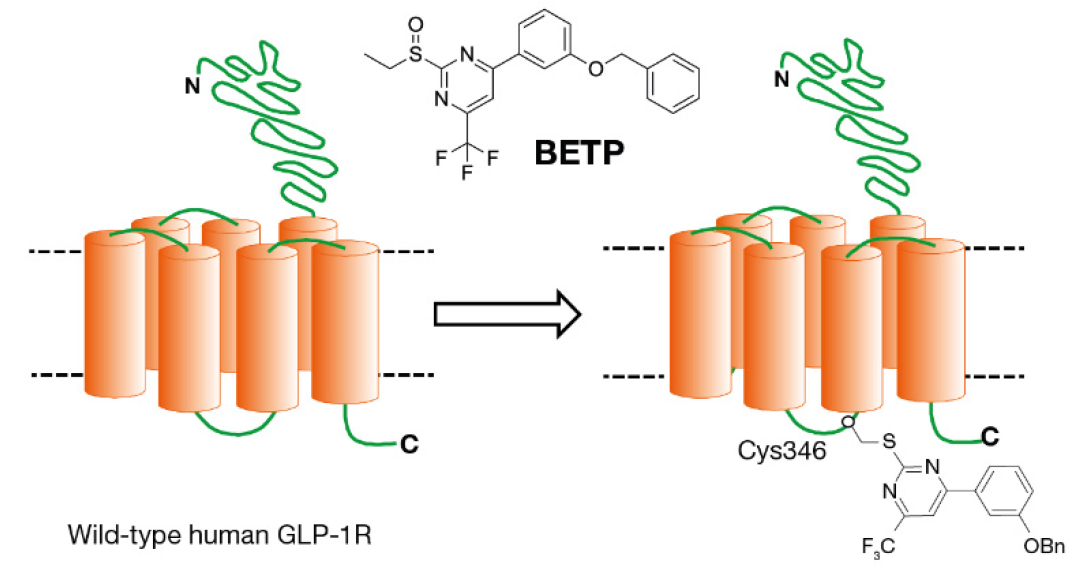
在确定方法之前,Pfizer分别利用已知的小分子和肽类GLP-1RA对BETP方法进行可行性验证。 验证通过之后,Pfizer利用此方法,筛选得到含有哌啶(hit化合物黄色部分)、5-氟-嘧啶(绿色部分)、苯并咪唑(蓝色部分)和4-氯-2-氟-苯结构的hit化合物。
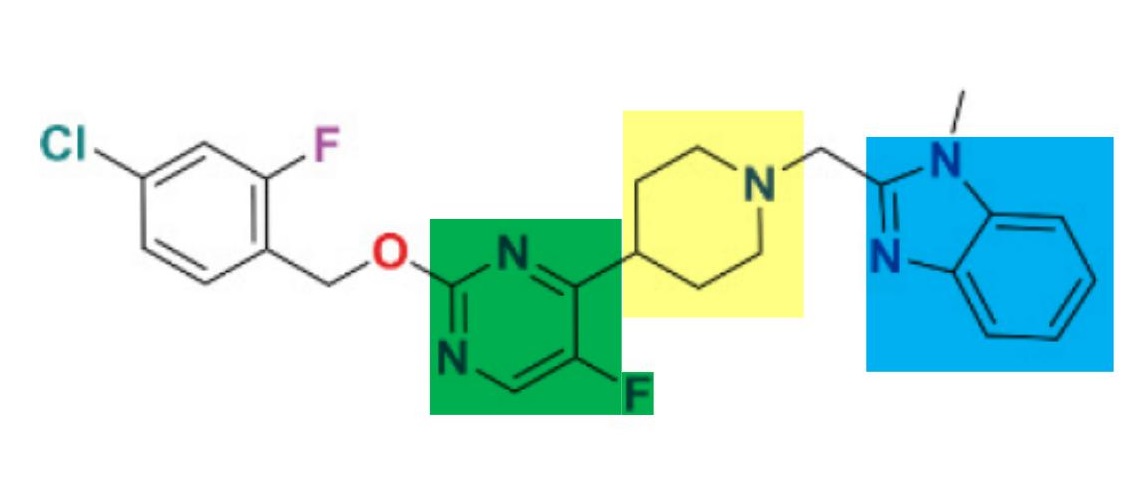
hit化合物
构效研究显示hit化合物上的哌啶环优于其它杂环,而用吡啶环替代hit化合物上的5-氟-嘧啶,以及用极性更强的6-氮杂苯并咪唑替代苯并咪唑后得到的化合物2,药效显著增强。尽管化合物2增强了疗效,但其有较高的亲脂性,使其易被肝脏清除,另外高亲脂性,也增强了化合物2和非目标靶点钾离子通道(hERG)的亲和力,导致产生脱靶效应。在氮杂苯并咪唑的基础上引入羧基后,并经优初步优化得到化合物3,化合物3在不降低药效的前提下,降低了药物的亲脂性。对化合物3的羧基结构的进一步优化得到化合物4,化合物4的清除速度和对于hERG亲和力都低于化合物2,并且化合物4显示出与类似于天然GLP-1募集β-arrestin蛋白的作用。天然GLP-1激活GLP-1R,除了通过偶联的G蛋白传导生物的信号,产生生物效应外,还通过募集β-arrestin来调整信号传递,β-arrestin通过与GLP-1R的细胞内结构结合,增强天然GLP-1促进β细胞分泌胰岛素的作用。保留化合物4的羧基结构,对苯并咪唑上取代基进行筛选并经进一步优化最终得到作用更强的PF-06882961(Danuglipron)。

通过比较Danuglipron对于人和小鼠GLP-1R的不同作用,证实Danuglipron通过GLP-1受体N端胞外结构域(ECD)第33位的色氨酸(Trp)发挥作用。此外Danuglipron还通过与GLP-1 R第1和第2膜外环(ECL)之间的相互作用,使Danuglipron在GLP-1R配体结合口袋中实现稳定。
2021年Aditi R. Saxena在6月期《Nature Medicine》发表的1期临床研究显示,Danuglipron不良反应主要是恶心、腹泻和呕吐。尽管未见到心脏相关的不良反应,但用药第28天的心率出现小幅增加。
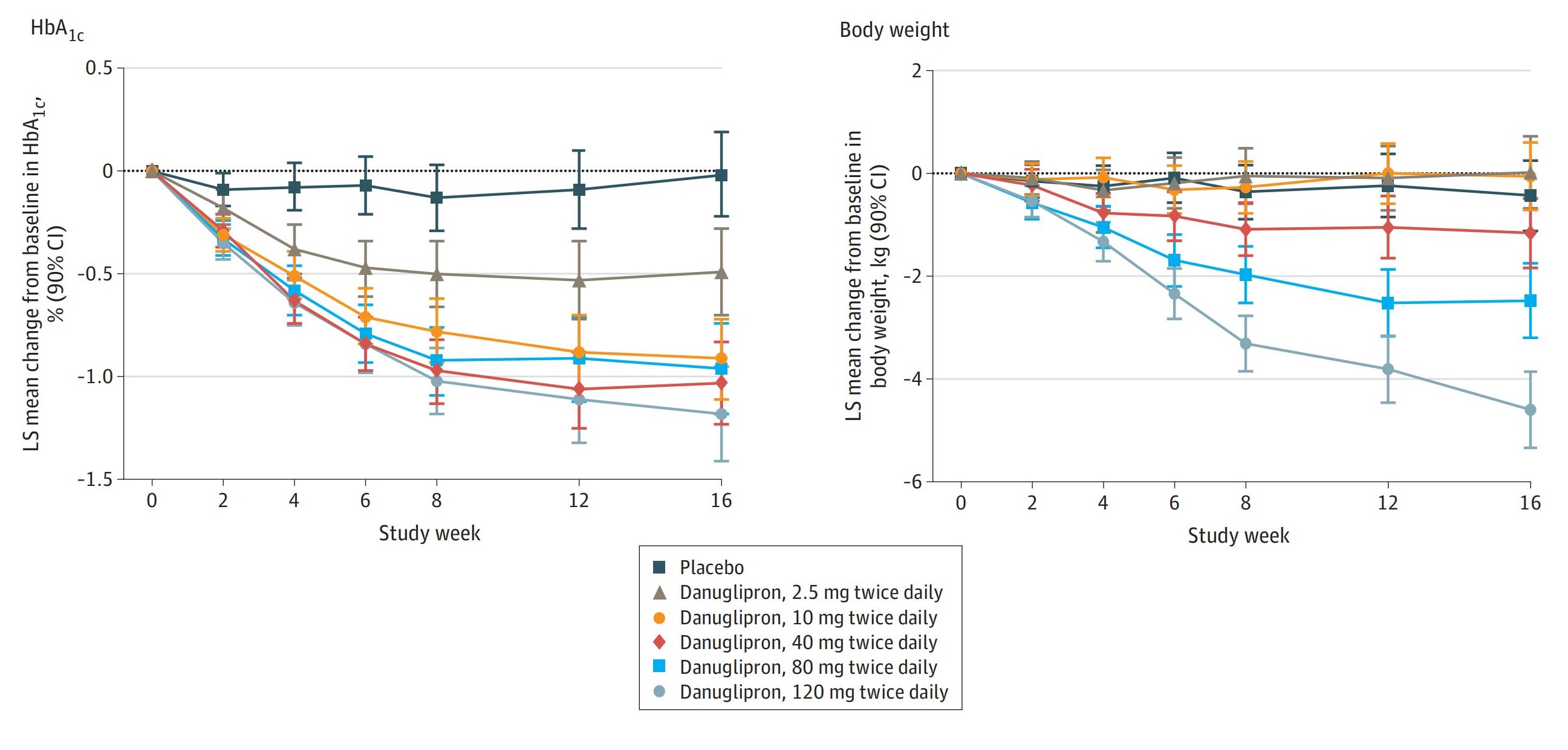
2023年Aditi R. Saxena在5月期《JAMA network open》发表的2b期临床研究显示,Danuglipron试验组中120mg一天二次剂量组的糖化血红蛋白(HbA1c)在第16周与安慰剂对照组相比,相对下降了-1.16%,而体重与80mg剂量组相对下降了2.04 kg,120mg剂量组相对下降了4.17 kg。
2023年12月1日Pfizer在线了Danuglipron的2b期临床试验结果。Danuglipron的3个滴定列队分别按40mg、80mg、120mg、160mg和200mg每日两次每1周、每2周进行滴定,共治疗超过26周,以及按80mg、140mg和200mg每4周进行滴定,共治疗超过32周。试验结果显示Danuglipron治疗第26周与基线相比各列队体重平均降低4.8%至9.4%,与安慰剂对照组相比体重相对降低5%至9.5%,Danuglipron治疗第38周,各列队体重平均降低6.9%至11.7%,与安慰剂对照组相比相对降低8%到13%。在不良反应方面,Danuglipron恶心的发生率为73%,呕吐为47%,腹泻为25%。各剂量组均有超过半数的Danuglipron受试者选择停药,安慰剂对照组停药率接近40%。
基于该2期临床试验结果,Pfizer宣布暂停Danuglipron普通制剂的开发,并转为开发Danuglipron一天给药一次的缓释制剂。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3