来源:TiumBio 750
2024年5月7日TiumBio公布了Merigolix治疗中重度子宫内膜异位症相关疼痛2a期临床试验的试验数据。
Merigolix是一种口服小分子非肽类促性腺激素释放激素(GnRH) 拮抗剂。与传统GnRH激动剂相比,Merigolix使用更好方便和和安全。
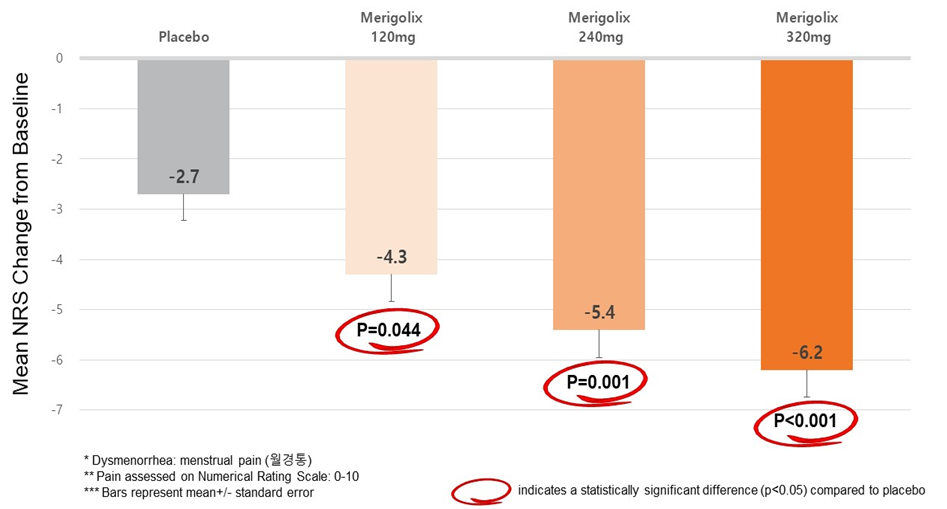
该2a期临床数据显示,与安慰剂相比,Merigolix三个剂量组在减少主要终点痛经评分方面,都显示出统计学上的显著差异。120mg剂量组平均降低4.3分(p=0.044),240mg剂量组平均降低5.4分(p=0.001)、320mg剂量组平均降低6.2分(p<0.001),安慰剂组平均降低2.7分。
在安全性方面,Merigolix显示出良好的耐受性,没有出现与治疗有关的严重不良事件。受试者最常见的不良事件包括潮热、头痛和恶心。
本次2a期临床试验,共纳入五个欧洲国家的 86 名中重度子宫内膜异位症相关疼痛女性患者,用于评估Merigolix治疗子宫内膜异位症中的疗效和安全性。入组患者随机分配接受 Merigolix 120 mg、Merigolix 240 mg、Merigolix 320 mg 或安慰剂,每日一次 (QD),持续治疗12周。试验通过使用《数字疼痛评分量表 (NRS)》测量过去一个月平均痛经评分,评估子宫内膜异位症相关疼痛从基线到12 周的变化情况。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。


2024年5月7日TiumBio公布了Merigolix治疗中重度子宫内膜异位症相关疼痛2a期临床试验的试验数据。
发布日期:2024-05-07 浏览数:749
横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3