来源:葛兰素史克 107
2025年12月16日,葛兰素史克GSK宣布美国食品药品监督管理局(FDA)已批准德莫奇单抗(Exdensur)用于12岁及以上儿童和成人嗜酸性粒细胞性重度哮喘的附加维持治疗。

本次获批基于两项重复、随机、安慰剂对照3期临床试验SWIFT-1和SWIFT-2的研究结果。SWIFT-1和SWIFT-2共纳入762名重度哮喘患者。入组患者按2:1比例在标准治疗(中高剂量吸入性糖皮质激素及至少一种其他哮喘控制药物)的基础上,在第0周和第26周皮下注射100mg德莫奇单抗,或安慰剂。至第52周,德莫奇单抗组和安慰组在SWIFT-1研究中的年化哮喘急性发作率分别为0.46(95% CI, 0.36至0.58)和 1.11(95% CI, 0.86至1.43), 在SWIFT-2研究中的年化哮喘急性发作率分别为 0.56(95% CI, 0.44 至 0.70)和1.08(95% CI, 0.83至1.41)。SWIFT-1和SWIFT-2研究德莫奇单抗分别降低了58%(RR 0.42; 95% CI, 0.30至0.59, p<0.001)和48%(RR 0.52; 95% CI, 0.36至0.73, p<0.001)的年化哮喘发作率。在SWIFT-1研究中,德莫奇单抗组和安慰组由于急性发作导致需要住院和/或急诊的发生率,分别为1%和8%。在SWIFT-2研究中,导致需要住院和/或急诊的发生率分别为4%和10%。SWIFT-1和SWIFT-2研究汇总,与安慰组相比,德莫奇单抗组降低72%(RR 0.28, 95% CI, 0.13至0.61)住院和/或急诊的发生率。在安全性方面,德莫奇单抗组不良事件发生率和严重程度与安慰剂组相似(David J Jackson., 2024)。
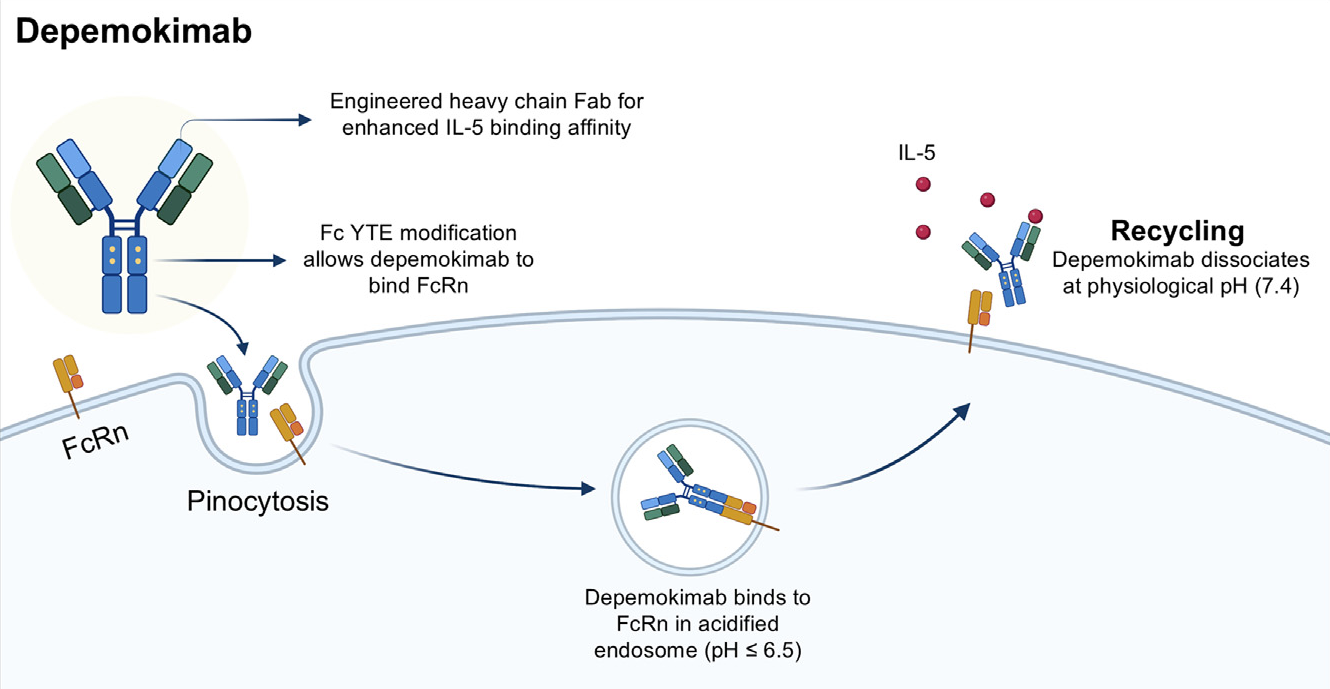
德莫奇单抗(Depemokimab)为超长效抗IL-5单克隆抗体,其氨基酸序列与美泊利珠单抗(Mepolizumab)相似。在美泊利珠单抗的重链可变区域引入4个氨基酸突变,以增强对于IL-5的亲和力,在Fc段引入YTE突变,以增强在酸性环境中与FcRn亲和力。德莫奇单抗与细胞表面的FcRn受体结合后,会被细胞内吞进入溶酶体,溶酶体内pH值显酸性,在溶酶体内与FcRn亲和力越强,FcRn复合物越不容易被溶酶体降解。没有降解的德莫奇单抗FcRn复合物会重样回到细胞表面,在中性环境下解放出德莫奇单抗,实现延长作时,一年只需给药两次(Santi Nolasco., 2024)。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。


2025年8月31日,迈威生物宣布其抗IL-11单抗用于病理性瘢痕2期临床试验申请已获得国家药品监督管理局(NMPA)受理,有望于2025年底启动该临床试验。
发布日期:2025-08-31 浏览数:286

2025-11-30,迈威生物发布9MW1911用于中重度慢性阻塞性肺疾病(COPD)2a期临床试验9MW1911-C03的研究结果。
发布日期:2025-11-30 浏览数:204

2025年12月22日,葛兰素史克GSK宣布,中国国家药品监督管理局(NMPA)已批准新可来®(美泊利珠单抗注射液)用于未充分控制的以血嗜酸性粒细胞升高为特征的慢性阻塞性肺疾病(COPD)成人患者的维…
发布日期:2025-12-22 浏览数:108

2025年12月16日,葛兰素史克GSK宣布美国食品药品监督管理局(FDA)已批准德莫奇单抗(Exdensur)用于12岁及以上儿童和成人嗜酸性粒细胞性重度哮喘的附加维持治疗。
发布日期:2025-12-16 浏览数:106
横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3