
Survodutide是GLP-1/Gcg双受体激动剂,在胰高血糖素(Glucagon,Gcg)结构的基础上杂合了胰高血糖素样肽-1(GLP-1)的部分结构,实现GLP-1/Gcg双重激动。并通过连接子引入 二元脂肪酸链,实现按周给药。
结构:
介绍:
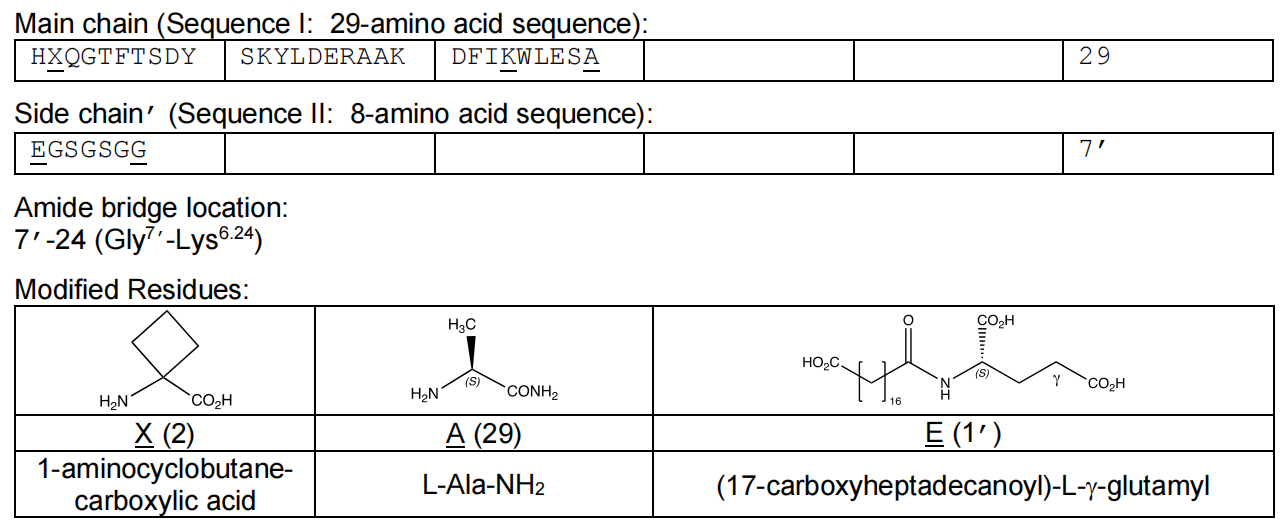
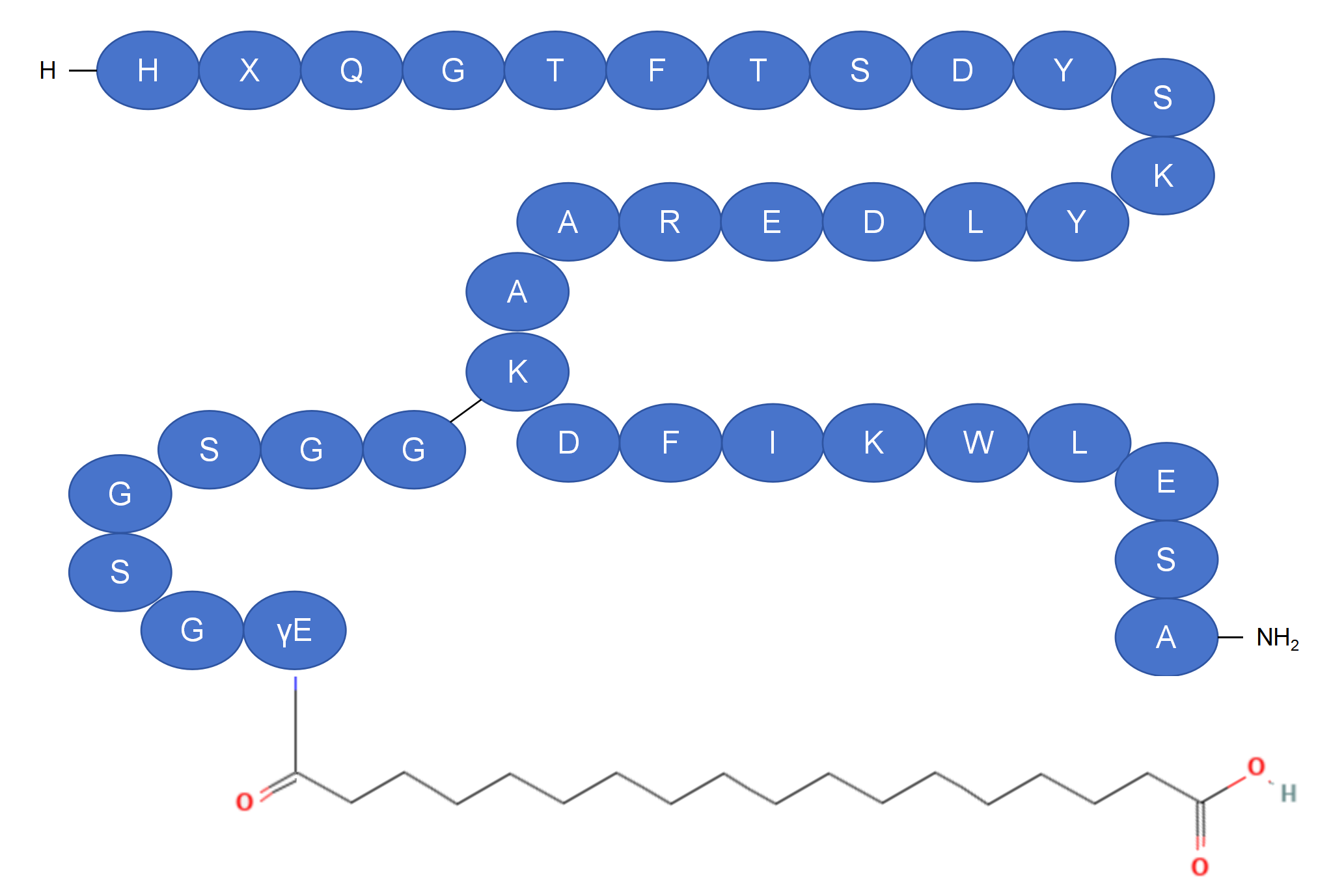
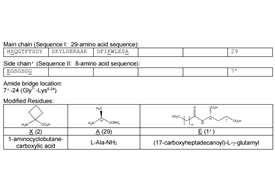
Survodutide(研发编号BI 456906)是西兰Zealand 公司开发的 GLP-1/Gcg双受体激动剂。Survodutide在胰高血糖素(Glucagon,Gcg)结构的基础上杂合了胰高血糖素样肽-1(GLP-1)的部分结构,实现GLP-1/Gcg双重激动。Survodutide肽链的第2位引入非天然氨基酸1-氨基-1-环丁烷羧酸(1-aminocyclobutane-1-carboxylic acid,Ac4c),增强了肽链抗二肽基肽酶4(DPP4)的能力。Survodutide将胰高血糖素肽链第24位的谷氨酰胺(Q)残基替换为赖氨酸(K)残基,并使用甘氨酸(G)和丝氨酸(S)作为链接子,通过γ谷氨酸(γE)接入含有18个碳原子的二元脂肪酸链。Survodutide的脂肪酸侧链结构,能够与血清蛋白结合,延长药物在体内的作用时间,可实现按周给药。
| 药物 | 氨基酸序列 | X:Ac4c | |||||||||||||||||||||||||||||
| GLP-1(7-37) | H | A | E | G | T | F | T | S | D | V | S | S | Y | L | E | G | Q | A | A | K | E | F | I | A | W | L | V | K | G | R | G |
|
胰高血糖素 |
H | S | Q | G | T | F | T | S | D | Y | S | K | Y | L | D | S | R | R | A | Q | D | F | V | Q | W | L | M | N | T | ||
|
Pemvidutide |
H | X | Q | G | T | F | T | S | D | Y | S | K | Y | L | D | E | R | A | A | K | D | F | I | K | W | L | E | S | A |
|
|
|
|
|||||||||||||||||||||||||||||||
2011年勃林格殷格翰Boehringer Ingelheim公司与Zealand 签定协议获得Zealand按日给药GLP-1/Gcg双受体激动剂ZP2929的开发权利。2014年Boehringer Ingelheim与Zealand修改协议,改为开发按周给药的GLP-1/Gcg双受体激动剂。2017年Boehringer Ingelheim启动了按周给药的GLP-1/Gcg双受体激动剂BI 456906的1期临床试验。1b期多剂量研究显示BI 456906受试者第6周体重平均降低5.79%,第16周平均降低-13.6%(Arvid Jungnik MD,2022)
2019年9月3日Boehringer Ingelheim宣布启动Survodutide(BI 456906)治疗肥胖或超重的2期临床试验(Boehringer Ingelheim,2019)。2021年4月13日Boehringer Ingelheim宣布启动Survodutide治疗非酒精性脂肪性肝炎(NASH)合并肥胖或超重的2期临床试验(Boehringer Ingelheim,2021)。
Survodutide治疗疗肥胖或超重的2期临床试验于2023年6月23日公布。使用SurvodutideI治疗46周,4.8 mg剂量组平均体重降幅近19%。67%的受试者降幅超过15%。Survodutide总体耐受性良好,严重不良反应的发生率Survodutide与安慰剂相近(4.2% VS 6.5%),3.9%的Survodutide使用者由于不良事件导致停药,主要的停药不良事件主要为胃肠道不良事件(Boehringer Ingelheim,2023)。
2023年10月5日Boehringer Ingelheim宣布启动Survodutide的3期临床试验SYNCHRONIZE-1、SYNCHRONIZE-2和SYNCHRONIZE-CVOT。 SYNCHRONIZE-1、SYNCHRONIZE-2用于评价Survodutide治疗不合并或合并糖尿病的超重或肥胖患者的安全性和有效性。SYNCHRONIZE-CVOT用于评价超重或肥胖患者长期使用Survodutide对于心血管疾病、慢性肾病及心血管疾病事件发生风险的影响(Boehringer Ingelheim,2023)。
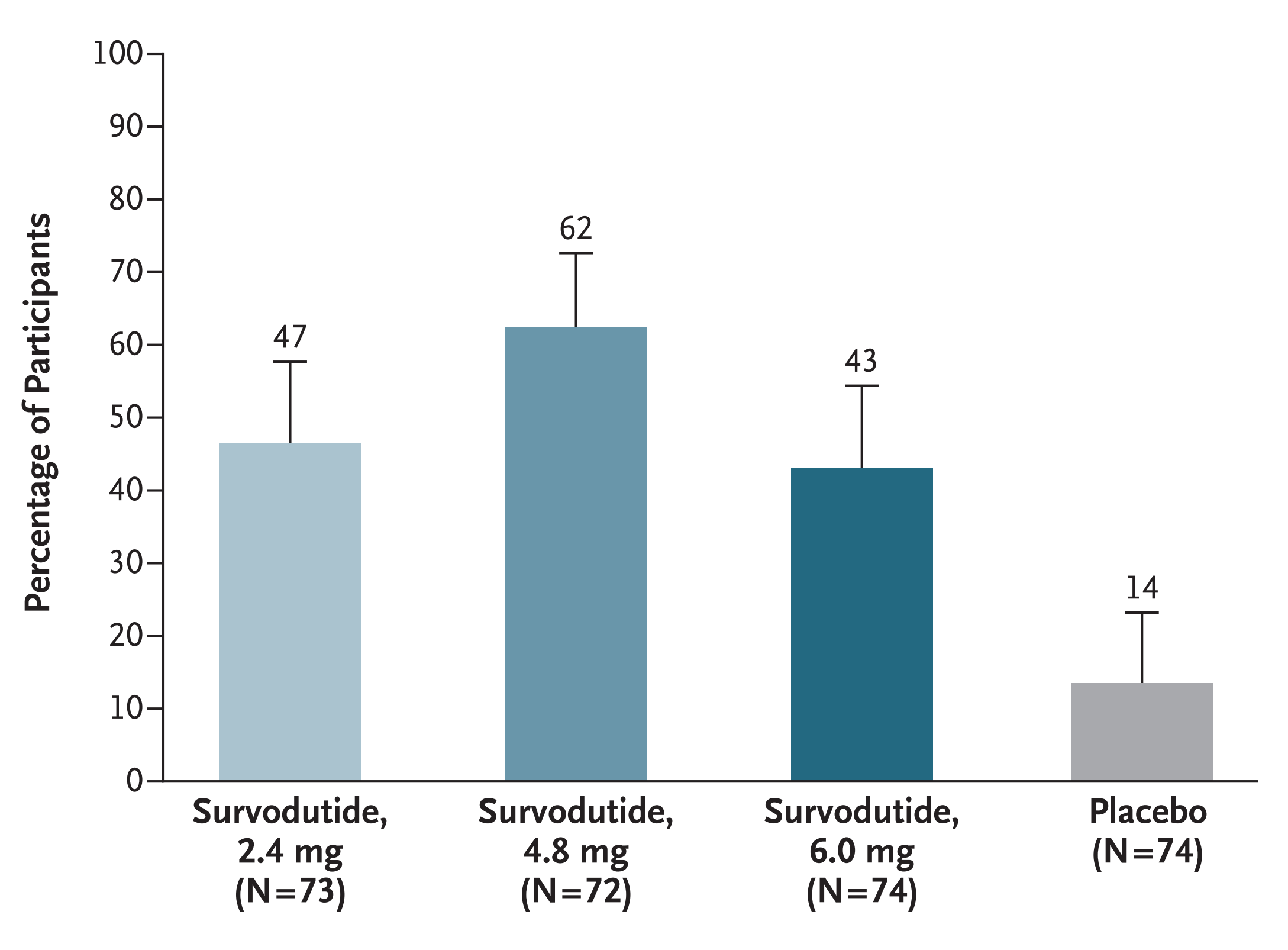
2024年,Arun J Sanyal等人发表Survodutide治疗肝活检证实为肝纤维化F1至F3期的成人代谢相关脂肪性肝炎(MASH)的2期临床试验结果。该试验共纳入 295 名受试者按1:1:1:1随机每周皮下注射一次Survodutide 2.4、4.8、6.0 mg或安慰剂,治疗48周。前24周为滴定阶段,逐渐将剂量滴定至2.4mg、4.8mg和6.0mg,后24周为剂量持阶段。至第48周,Survodutide 2.4mg、4.8mg和6.0mg剂量组 MASH改善且肝纤维化没有发生恶化比例分别为47%、62%、43%,显著高于安慰剂组14% (p均<0.001)。肝脏脂肪含量相对降低≥30%的比例分为63%、67%、57%和14%。肝纤维化改善≥1期的比例分别为34%、36%、34%和22%。Survodutide组对比安慰剂,常见不良事件分别为恶心(66% vs. 23%)、腹泻(49% vs. 23%)、和呕吐(41% vs. 4%)。Survodutide组严重不良事件的发生率为8%,安慰剂为7%(Arun J Sanyal., 2024)。
(校对20240612)

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。


GLP-1/Gcg双受体激动剂1290
GLP-1/Gcg双受体激动剂977
GLP-1/Gcg双受体激动剂719

GLP-1/Gcg双受体激动剂665
横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3