
纳武利尤单抗是人源化IgG4抗PD-1单克隆抗体。不诱导不良免疫相关事件。
结构:

介绍:
纳武利尤单抗(Nivolumab,商品名:欧狄沃Opdivo,研发代号BMS-936558/ONO-4538/MDX-1106)是小野药品工业株式会社Ono Pharmaceutical和Medarex合作开发的人源化IgG4抗PD-1单克隆抗体。小野药品的研发代号ONO-4538,Medarex的研发代号MDX-1106。
2009年,Medarex被百时美施贵宝Bristol-Myers Squibb收购(Bristol-Myers Squibb., 2009),BMS-936558为百时美施贵宝的研发代号。
2011年百时美施贵宝与小野药品达成合作协议获得纳武利尤单抗除日本、韩国和中国台湾之外的全球开发和商业化权利,2014年百时美施贵宝进一步获得纳武利尤单抗在日本、韩国和中国台湾的合作开发和商业化权利。
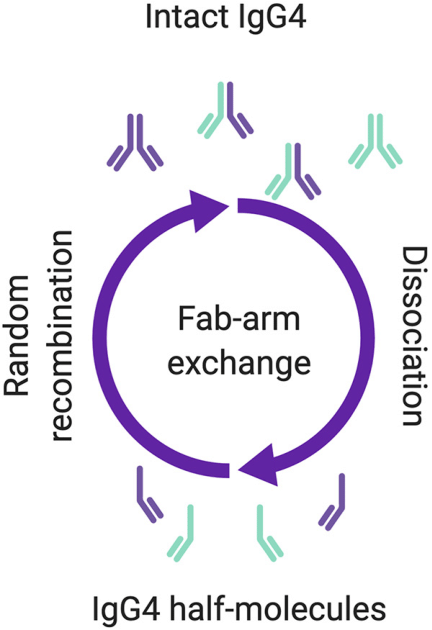
纳武利尤单抗在人源化IgG4抗体的基础上引入S228P突变,以避免发生Fab交换。动物实验显示纳武利尤单抗不诱导不良免疫相关事件(Changyu Wang., 2014)。
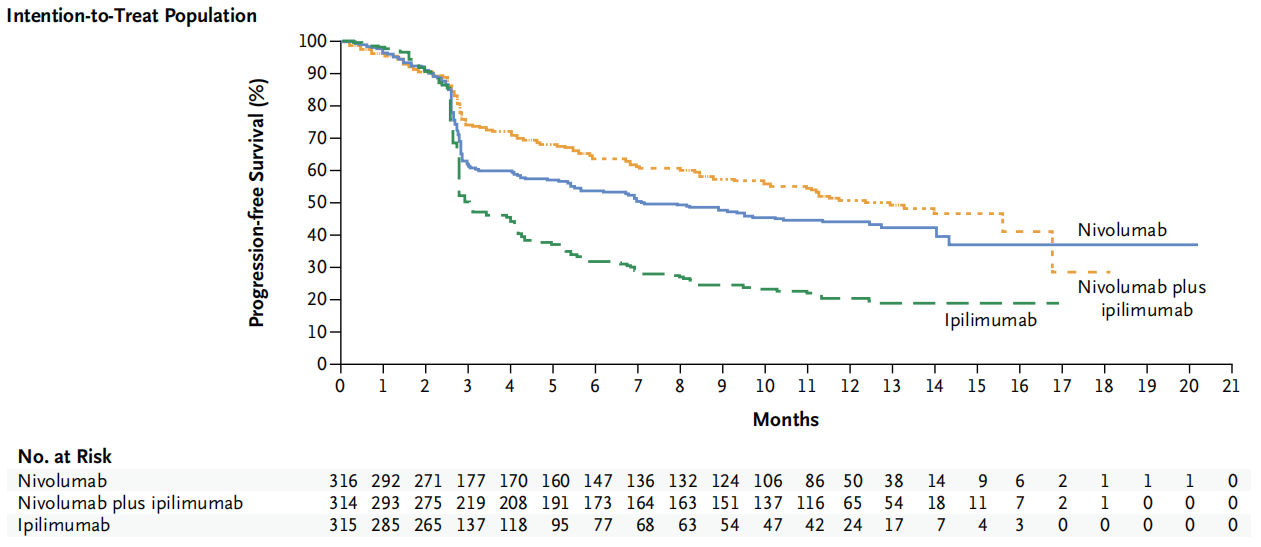
2015年,James Larkin等人发表纳武利尤单抗用于黑色素瘤3期临床试验CheckMate 067的研究结果。CheckMate 067为随机、双盲、多中心、3期临床试验,共纳入945名既往未经治疗的不可切除Ⅲ期或Ⅳ期黑色素瘤患者。患者按1:1:1比例随机接受每2周3 mg/kg纳武利尤单抗,或每3周1 mg/kg纳武利尤单抗联合3mg /kg伊匹木单抗共4次,之后每2周3 mg/kg纳武利尤单抗,以及3mg /kg伊匹木单抗共4次进行治疗。研究结果显示纳武利尤单抗和伊匹木单抗联合用药组中位无进展生存期为11.5个月(95% CI: 8.9-16.7),伊匹木单抗单用组为2.9个月(95% CI: 2.8- 3.4), 纳武利尤单抗单用组为6.9个月(95% CI: 4.3-9.5)。联合用药组与伊匹木单抗单用组疾病进展或死亡的风险比为0.42(99.5% CI, 0.31-0.57; P<0.001),纳武利尤单抗单用组与伊匹木单抗单用组疾病进展或死亡的风险比为0.57(99.5% CI, 0.43- 0.76; P<0.001)。对于PD-L1阳性患者,联合用药组与纳武利尤单抗单用组的中位无进展生存期为14.0个月。对于于PD-L1阴性患者,联合用药组与纳武利尤单抗单用组的中位无进展生存期分别为11.2个月[95% CI, 8.0-未达到)和5.3个月(95% CI, 2.8-7.1)。3级或4级治疗相关不良事件发生率,纳武利尤单抗单用组是16.3%,联合用药组是55.0%,伊匹木单抗单用组是27.3%(James Larkin., 2015)。
2014年,FDA批准Opdivo(纳武利尤单抗)用于对对其他药物不再有反应的不可切除(无法通过手术切除)或转移性(晚期)黑色素瘤。
2015年,FDA批准Opdivo(纳武利尤单抗)用于铂类化疗期间或之后进展的晚期(转移性)鳞状非小细胞肺癌(NSCLC)。
同年,FDA批准Opdivo(纳武利尤单抗)联合Yervoy(伊匹木单抗)用于BRAF V600野生型不可切除或转移性黑色素瘤。
同年,FDA批准Opdivo(纳武利尤单抗)用于铂类化疗期间或之后疾病进展的晚期(转移性)非小细胞肺癌。
同年,FDA批准Opdivo(纳武利尤单抗)用于既往接受过某种治疗期晚期(转移性)肾细胞癌。
2016年,FDA批准Opdivo(纳武利尤单抗)联合Yervoy(伊匹木单抗)用于用于治疗BRAF V600野生型和BRAF V600突变阳性不可切除或转移性黑色素瘤患者。
同年,FDA批准Opdivo(纳武利尤单抗)用于自体造血干细胞移植(auto-HSCT)及移植后使用维布妥昔单抗治疗后复发或进展的经典霍奇金淋巴瘤(cHL)。
同年,FDA批准Opdivo(纳武利尤单抗)用于铂类治疗期间或之后疾病进展的复发性或转移性头颈部鳞状细胞癌(SCCHN)。
2017年,FDA批准Opdivo(纳武利尤单抗)用于铂化疗期间或之后出现疾病进展或在接受新辅助或辅助治疗后12个月内出现疾病进展的局部晚期或转移性尿路上皮癌(mUC)。
同年,FDA批准Opdivo(纳武利尤单抗)用于在接受氟嘧啶、奥沙利铂和伊立替康治疗后进展的微卫星高度不稳定 (MSI-H) 或错配修复缺陷 (dMMR) 的成人和儿童(12 岁及以上)转移性结直肠癌患者(mCRC)。
同年,FDA批准Opdivo(纳武利尤单抗)用于既往接受过索拉非尼治疗的肝细胞癌(HCC)。
同年,FDA批准Opdivo(纳武利尤单抗)用于淋巴结受累或转移黑色素瘤完全切除后的辅助治疗。
2018年,FDA批准Opdivo(纳武利尤单抗)联合Yervoy(伊匹木单抗)用于既往未接受过治疗的中低风险晚期肾细胞癌(RCC)。
同年,FDA批准Opdivo(纳武利尤单抗)联合Yervoy(伊匹木单抗)用于在接受氟嘧啶、奥沙利铂和伊立替康治疗后进展的微卫星高度不稳定 (MSI-H) 或错配修复缺陷 (dMMR) 的成人和儿童(12 岁及以上)直肠癌(mCRC)。
2018年,FDA批准Opdivo(纳武利尤单抗)用于铂类化疗和至少一种其他治疗后癌症进展的转移性小细胞肺癌(SCLC)。
2020年,FDA批准Opdivo(纳武利尤单抗)联合Yervoy(伊匹木单抗)用于既往接受过索拉非尼治疗的患者的肝细胞癌(HCC)。
同年,FDA批准Opdivo(纳武利尤单抗)联合Yervoy(伊匹木单抗)一线治疗无EGFR或ALK突变,肿瘤表达PD-L1(≥1%)的成年转移性非小细胞肺(NSCLC)。
同年,FDA批准Opdivo(纳武利尤单抗)联合Yervoy(伊匹木单抗)一线治疗无EGFR或ALK突变成人转移性或复发性非小细胞肺癌(NSCLC)。
同年,FFDA批准Opdivo(纳武利尤单抗)用于治疗既往接受过氟嘧啶类和铂类化疗后无法切除的晚期、复发性或转移性食管鳞状细胞癌(ESCC)。
同年,FDA批准Opdivo(纳武利尤单抗)联合Yervoy(伊匹木单抗)一线治疗成人用于不可切除的恶性胸膜间皮瘤(MPM)。
同年,由于未达到总生存期未达到主要终点,百时美施贵宝宣传撤回Opdivo(纳武利尤单抗)用于铂类化疗和至少一种其他治疗后癌症进展的转移性小细胞肺癌(SCLC)相关适应症。
2021年,FDA批准Opdivo(纳武利尤单抗)联合Cabozantinib一线治疗晚期肾细胞癌(RCC)。
同年,FDA批准Opdivo(纳武利尤单抗)用于晚期或转移性胃癌、胃食管交界处癌和食管腺癌。
同年,FDA批准Opdivo(纳武利尤单抗)用于接受新辅助放化疗(CRT),完全切除后带有残留病理的食管癌或胃食管交界处 (GEJ)癌的辅助治疗。
同年,由于总生存期未达到主要终点,百时美施贵宝宣传撤回Opdivo(纳武利尤单抗)用于既往接受过索拉非尼治疗的肝细胞癌(HCC)相关适应症。
同年,FDA批准Opdivo(纳武利尤单抗)用于接受根治性切除术后高复发风险尿路上皮癌(UC)的辅助治疗。
2022年,FDA批准Opdivo(纳武利尤单抗)联合铂类双药化疗,每三周一次,持续三个周期,用于接受新辅助治疗的可切除(肿瘤 ≥4 cm 或淋巴结阳性)成年非小细胞肺癌 (NSCLC)。
同年,FDA批准Opdivo(纳武利尤单抗)联合含氟嘧啶和铂类化疗,以及纳武利尤单抗联合 Yervoy(伊匹木单抗)一线治疗不可切除的晚期或转移性食管鳞状细胞癌(ESCC)。
2023年,FDA批准Opdivo(纳武利尤单抗)用于 12 岁及以上儿童和成人完全切除的ⅡB 期或ⅡC期黑色素瘤的辅助治疗。
2024年,FDA批准Opdivo(纳武利尤单抗)与顺铂和吉西他滨联合一线治疗不可切除或转移性 成年尿路上皮癌(UC)。
同年,FDA批准Opdivo(纳武利尤单抗)用于无已知表皮生长因子受体 (EGFR)突变或间变性淋巴瘤激酶(ALK)重排的成年可切除(肿瘤≥4 cm 或淋巴结阳性)非小细胞肺癌 (NSCLC)。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3