
替尔泊肽(Zepbound)为Eli Lilly礼来开发的GIP/GLP-1双受体激动剂,于2023年11月8日获得FDA批准用于治疗肥胖或超重。
结构:
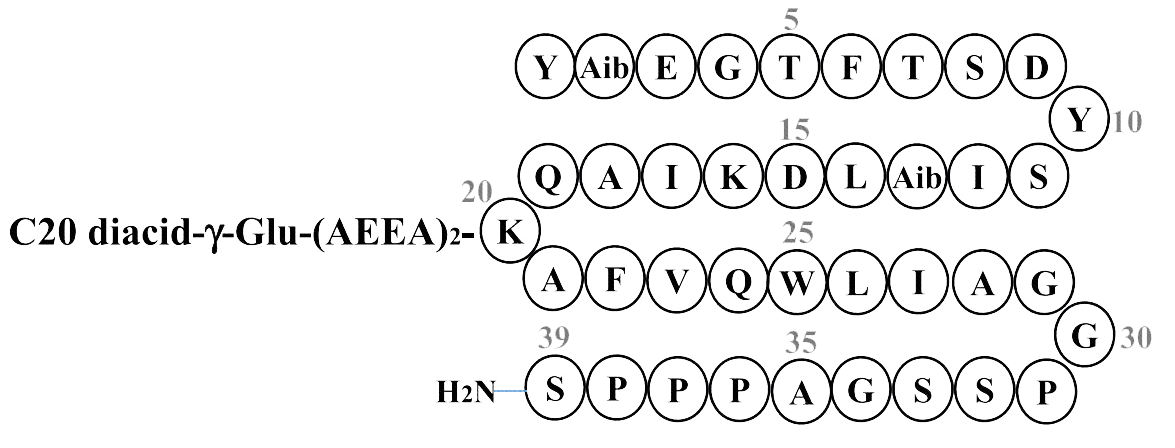
介绍:
替尔泊肽是第一个上市的GIP/GLP-1双受体激动剂,由Eli Lilly礼来开发。替尔泊肽的肽链由39个氨基酸组成,肽链中第1-28位为GIP的类似物,第7、第14和第20位引入和GLP-1相同的氨基酸残基,并在第20位的赖氨酸残基接入一条与司美格鲁肽相似的含有20个碳原子的脂肪酸链,第2和13位为非天然氨基酸Aib,第29-39位和非人源性GLP-1受体激动剂Exendin-4后11位相同。
| 药物 | 氨基酸序列 | X:Aib | |||||||||||||||||||||||||||||
|
|
1 |
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
30 |
|
| GLP-1(7-37) | H | A | E | G | T | F | T | S | D | V | S | S | Y | L | E | G | Q | A | A | K | E | F | I | A | W | L | V | K | G | R | G |
| GIP | Y | A | E | G | T | F | I | S | D | Y | S | I | A | M | D | K | I | H | Q | Q | D | F | V | N | W | L | L | A | Q | K | KNDWKHIT |
| 替尔泊肽 | Y | X | E | G | T | F | T | S | D | Y | S | I | X | L | D | K | I | H | Q | K | A | F | V | Q | W | L | I | A | G | G | PSSGAPPPS |
|
|
|||||||||||||||||||||||||||||||
动物试验显示替尔泊肽与司美格鲁肽相比,降糖治疗相似,减重作用更优。Ⅱ期临床试验显示,无论是降糖还是减重效果替尔泊肽都优于Eli Lilly的长效GLP-1 RA度拉糖肽。而Ⅲ期临床试验显示,三个剂量组替西帕肽(5mg、10mg、15mg)的降糖和减重效果都优于1mg剂量组的司美格鲁肽。
2022年6月发表的替西帕肽SURMOUNT-1试验结果显示使用替西帕肽治疗72周后,5mg剂量组的减重幅度达到15.0%,10mg剂量组的减重幅度达到19.5%,15mg剂量组的减重幅度达到20.9%。基于SURMOUNT-1的实验结果。替尔泊肽于2022年10月6日获得FDA关于肥胖症的快速通道审批资格。
2023年10月15日《Nature Medicine》上刊登了成人超重或肥胖患者在强化生活方式干预后使用替尔泊帕肽的3期临床试验SURMOUNT-3的试验结果。SURMOUNT-3试验显示在12周强化生活干预的方式使体重降低幅度≥5%的基础上继续使用替尔泊肽I治疗72周,可使体重进一步降低18.4%(Thomas A Wadden et al., 2023)。
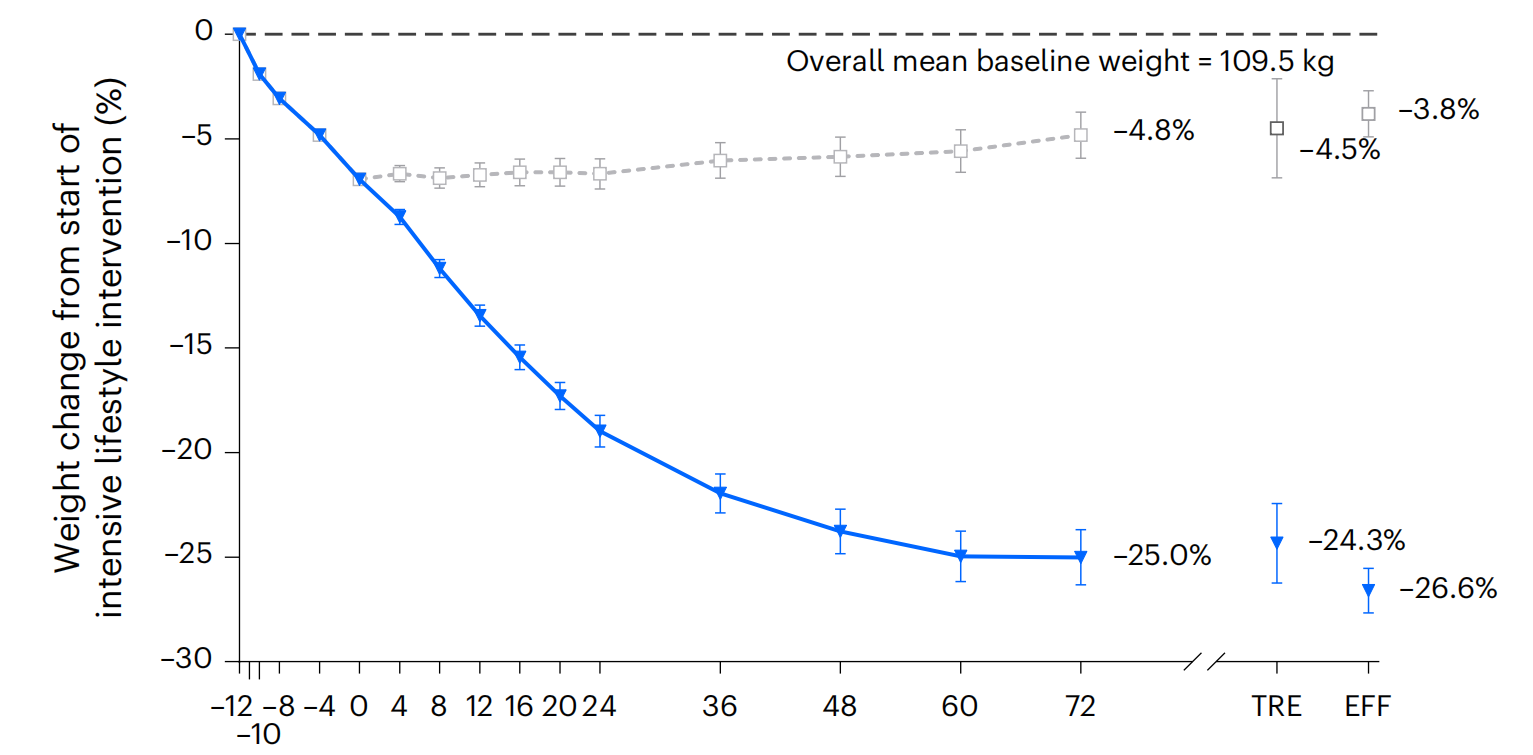
2023年11月8日礼来Eli Lilly在线宣布其GIP/GLP-1双受体激动剂类药物替尔泊肽(Zepbound)获得美国FDA批准用于BMI≥30的肥胖患者或BMI≥27并伴有高血压、血脂异常、2型糖尿病、阻塞性睡眠呼吸暂停或心血管疾病等与体重相关疾病的超重患者。
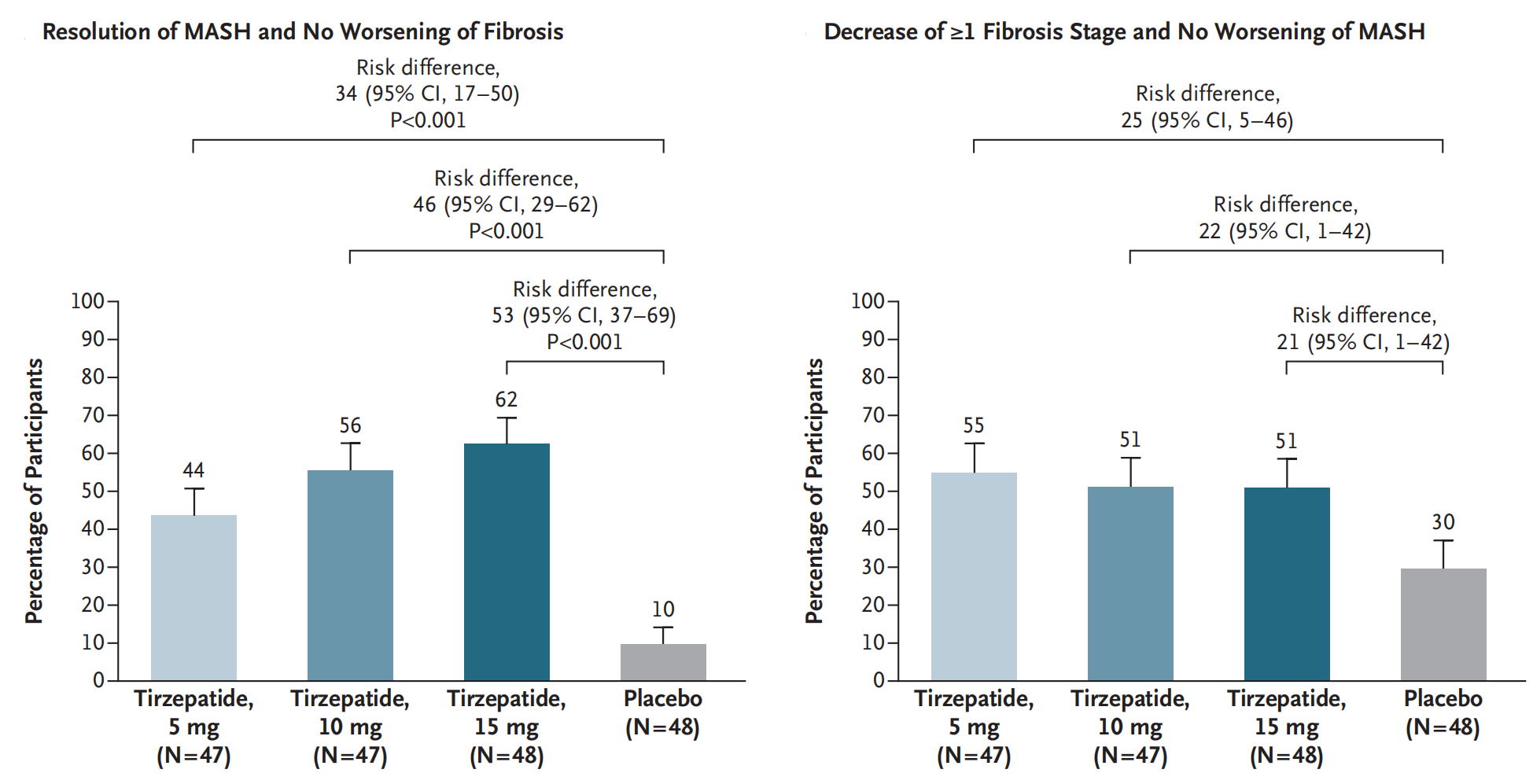
2024年,Rohit Loomba等人发表替尔泊肽Tirzepatide治疗成人代谢相关脂肪性肝炎(MASH)2期临床试验SYNERGY-NASH的试验结果。该试验共纳入190名MASH并伴有肝纤维化F2或F3期的患者,随机接受替尔泊肽5mg、10mg、15mg 或安慰剂,每周皮下注射一次,持续治疗52周。 与安慰剂相比替尔泊肽5mg、10mg、15mg MASH完全消退,且肝纤维化没有发生恶化的比例分别增加34%(95% CI 17-50)、46%(95% CI 29-62)、53%(95% CI 37-69),所有三个比较组均为P<0.001。替尔泊肽组MASH没有恶化且肝纤维化改善≥1期的比例分别增加25%(95% CI 5-46)、22%(95% CI 1-42)、21%(95% CI 1-42)。替尔泊肽组最常见的不良事件是胃肠道事件,大多数为轻至中度(Rohit Loomba., 2024)。
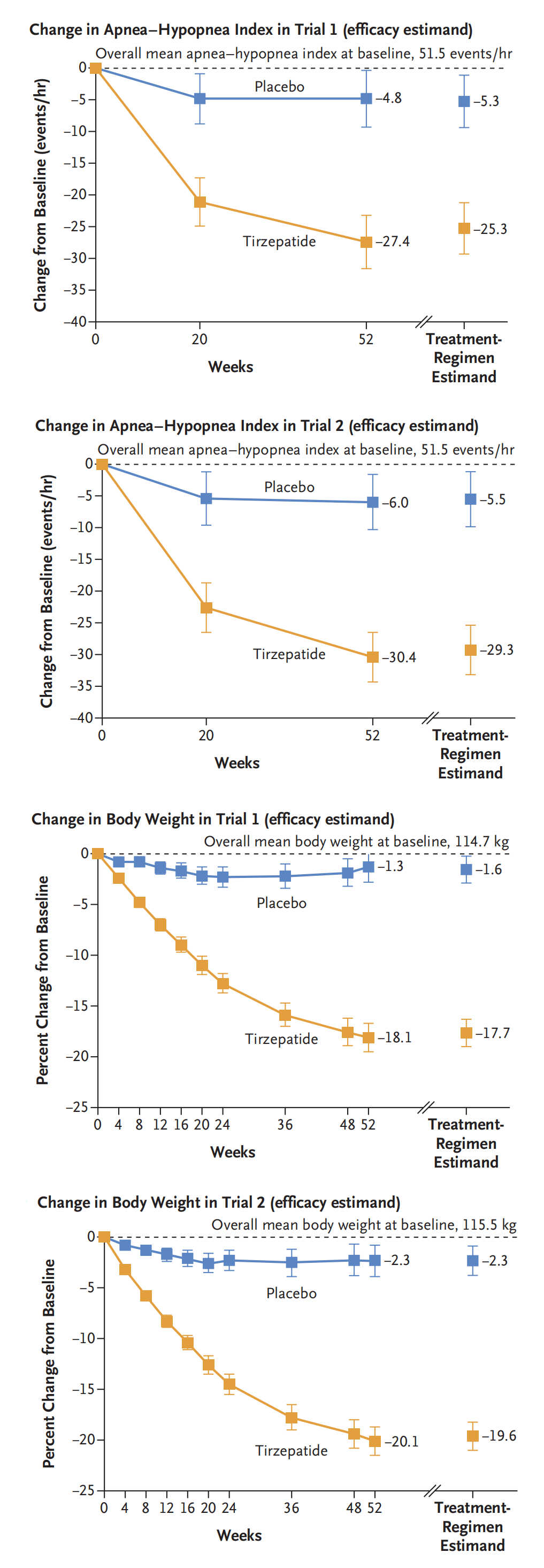
2024年,Atul Malhotra等人发表替尔泊肽(Tirzepatide)治疗肥胖合并睡眠呼吸暂停综合症3期临床试验SURMOUNT-OSA(NCT05412004)的试验结果。SURMOUNT-OSA包括两项多中心、平行组、双盲、随机、对照试验3期临床试验,为期52周。试验1纳入234名在基线时未接受气道正压通气(PAP)治疗肥胖合并中度至重度阻塞性睡眠呼吸暂停的受试者,试验2纳入235接受在基线时接受PAP治疗的受试者。入组患者按1:1比例随机分配接受替尔泊肽(最大耐受剂量10 mg或15 mg)或安慰剂,每周皮下注射一次持续 52周。在基线时,试验1受试者的平均呼吸暂停低通气指数(AHI)为每小时 51.5 次,试验2的平均AHI为每小时49.5次。至第52周,试验1替尔泊肽组AHI平均每小时减少25.3次(95% CI,-29.3至-21.2),安慰剂组平均减少5.3 次(95% CI,-9.4至-1.1)。替尔泊肽组相对于安慰剂平均每小时减少20.0(95% CI,-25.8至-14.2)(P<0.001)。试验2替尔泊肽组AHI平均每小时减少29.3次(95% CI,-33.2至-25.4),安慰剂组平均减少5.5 次(95% CI,-9.9至 -1.2)。替尔泊肽组相对于安慰剂平均每小时减少23.8(95% CI,-29.6至-17.9)(P<0.001)。在治疗期间替尔泊肽最常报告的不良事件主要胃肠道反应,严重程度大多为轻度至中度(Atul Malhotra., 2024)。
2024年7月19日,礼来Eli Lilly在其公众号上宣布其替尔泊肽制剂穆峰达(替尔泊肽注射液)获得国家药品监督管理局批准用于在控制饮食和增加运动基础上,体重指数(BMI)符合以下要求的成人的长期体重管理:≥28 kg/m2(肥胖),或≥24 kg/m2(超重)并伴有至少一种体重相关合并症(如:高血压、血脂异常、高血糖、阻塞性睡眠呼吸暂停、心血管疾病等)(礼来., 2024)。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3