来源:礼来Eli Lilly 764
2024年12月20日,礼来Eli Lilly宣布美国食品和药物管理局(FDA)已批准替尔泊肽在低热量饮食和运动的基础上,用于成人合并肥胖的阻塞性睡眠呼吸暂停。

该批准基于3期临床试验SURMOUNT-OSA的研究结果。SURMOUNT-OSA(NCT05412004)是的一项中心、随机、双盲、平行、安慰剂对照主研究方案(Master Protocol)3期临床试验。用于比较替尔泊肽与安慰剂在不能或不愿使用气道正压通气(PAP)治疗的中重度阻塞性睡眠呼吸暂停(OSA)合并肥胖患者(研究 1),以及在试验期间接受并计划继续接受PAP治疗(研究 2)中的有效性和安全性。该试验共纳入来自美国、澳大利亚、巴西、中国、捷克、德国、日本、墨西哥和中国台湾469例患者,按1:1 比例接受安慰剂或最大耐受剂量(MTD)10mg或15 mg的替尔泊肽,每周一次。替尔泊肽的起始剂量为2.5mg ,每4周增加2.5 mg,直至达到最大耐受剂量。能够耐受15 mg的受试者,以15 mg作为他们的最大耐受剂量。能够耐受10 mg但不耐受15 mg 的参受试者,以10mg作为他们的最大耐受剂量。
SURMOUNT-OSA研究结果显示,至第52周,替尔泊肽组使每小时呼吸中断次数减少25次,安慰减少5次。对于接受PAP治疗成年患者,与安慰剂组相比,Zepbound每小时的呼吸中断次数减少了29 次,治疗一年后42%的替尔泊肽使用者,及50%接受PAP治疗的替尔泊肽使用者,睡眠呼吸暂停完全缓解,或仅为轻度、无症状的OSA,而安慰剂组分别为16%和14%。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

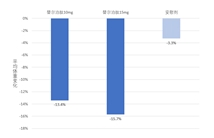
2023年4月27日礼来(Eli Lilly)公司公布了替尔泊肽(Tirzepatide)SURMOUNT-2临床试验的结果。经过72周的治疗,10mg替尔泊肽剂量组的平均减重幅度达到13.4%,15mg替尔泊肽剂量的平均减重幅度达到…
发布日期:2023-04-27 浏览数:2750

2023年11月8日礼来Eli Lilly在线宣布其GIP/GLP-1双受体激动剂类药物替尔泊肽(Zepbound)获得美国FDA批准用于BMI≥30的肥胖患者或BMI≥27 并伴有与体重相关疾病的超重患者。
发布日期:2023-11-08 浏览数:2698
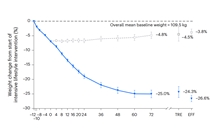
替尔泊肽(Tirzepatide)SURMOUNT-3临床试显示,12周严格生活干预加72周替尔泊肽,共实现减重26.6%。
发布日期:2023-07-27 浏览数:2614

2024年7月19日,礼来Eli Lilly在其公众号上宣布其替尔泊肽制剂穆峰达(替尔泊肽注射液)获得国家药品监督管理局批准用于在控制饮食和增加运动基础上,体重指数(BMI)符合以下要求的成人的长期体…
发布日期:2024-07-19 浏览数:2152
横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3