
Aduhelm(Aducanumab)是Neurimmune开发的抗Aβ单克隆 IgG1抗体。是第一个被FDA批准上市阿尔茨海默症(AD)免疫治疗药物。
结构:
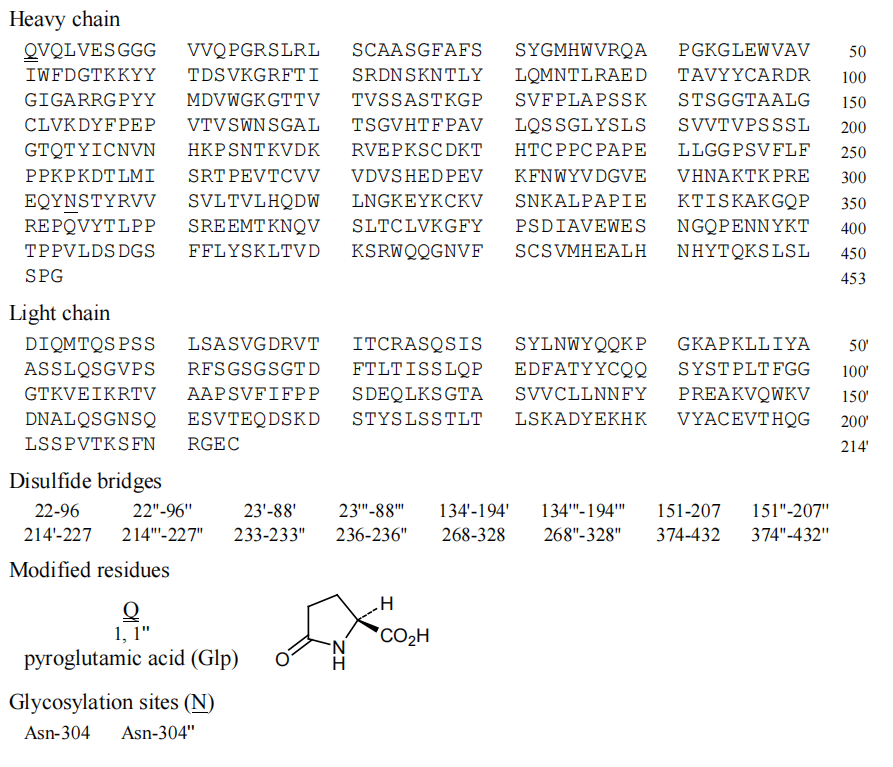
介绍:
Elan公司的AN-1792(Aβ42)疫苗,是第一个进入临床研究的阿尔茨海默症(AD)免疫治疗药物,由于部分受试者出现脑膜脑炎,导致AN-1792项目失败。AN-1792临床试验项目的分中心,瑞士苏黎世大学(University of Zurich)的Roger M Nitsch研究团队,负责AN-1792试验的苏黎世列队,已入组30例受试者。由于项目中止,Nitsch研究团队很想弄清楚是否由于接种AN-1792疫苗产生的抗β淀粉样蛋白(Aβ)抗体导致受试者出现脑膜脑炎。他们用已经收集的一例脑膜脑炎受试者的脊髓液处理AD患者和转基因小鼠的脑组织切片并进行染色,和免疫血清进行对比。由于脊髓液和免疫血清都仅能使Aβ斑块和血管壁上沉积的Aβ获得染色,排除了抗Aβ抗体直接引起脑膜脑炎的可能性。考虑到Aβ是由Aβ多肽聚集而来,而Aβ多肽由淀粉样蛋白前体(APP)分步切割而成,Aβ多肽单体和APP在大脑中普遍存在,由于未观察到大脑存在普遍染色现象,Nitsch的研究团队提出抗Aβ抗体选择识别Aβ的结构,并不是识别Aβ多肽单体或APP。2002年Nitsch的研究团队在11月期的《Nature Medicine》发表上述抗体染色研究结果。
随着注意到一些接种疫苗受试者的认知功能恶化程度趋于稳定,Nitsch的研究团队转向评估AN-1792对受试者认知功能的影响。在评价抗体滴度与认知功能改善之间的关系时,Nitsch的研究团队发现尽管在产生抗体的受试者中可以看到部分患者的认知功能趋于稳定,但受试者抗体的滴度与认知功能改善程度之间缺少相关意义。考虑到抗体可能受血脑屏障影响,Nitsch的研究团直接改为用抗体与斑块之间免疫反应的强度,来评估与认知功能改善之间的关系,正如之前所设想的,这两者之间存在明显的联系,接下来,他们又用实验推翻了抗体不易通过血脑屏障的这一假设,最终他们将抗体与斑块之间免疫反应的强度对认知功能影响这一研究结果发表在2003年5月期的《Neuron》上。Nitsch的研究团队不仅证实了AD的免疫治疗可以改善患者的认知功能,同时也暗示并不是所有抗体,只有能够识别Aβ结构的抗体,对改善认知功能有帮助。
2005年哈佛医学院麻省总医院Robert D. Moir在《The Journal of Biological Chemistry》4月期上发表的论文显示,AD患者与非AD患者相比血清中靶向Aβ多肽单体的抗体水平相似,而靶向Aβ寡聚体的抗体水平显著下降,提示靶向Aβ寡聚体的抗体可能有助于防止AD的发生。受此启发,Nitsch从认知功能正常老年人的外周淋巴细胞库中筛选出高度靶向Aβ寡聚体的IgG1抗体,并在此基础上开发出单克隆抗体NI-101。Nitsch于2006年成立 Neurimmune用于NI-101的后续开发。2007年Neurimmune将NI-101出售给Biogen渤健进行共同开发,NI-101的开发编号改为BIIB037,也就是Aducanumab。
药效学研究显示,Aducanumab与Aβ寡聚体的亲合力远远大于Aβ多肽单体,但仅能缩小早期AD试验动物的Aβ斑块。1a期临床研究显示≤30 mg/kg剂量组的受试者未出现严重不良反应,60mg剂量组的3名受试者均出现淀粉样蛋白相关成像异常(ARIA)。1b期临床显示,Aducanumab可改善前驱期和轻度AZ受试者Aβ斑块的PET成像。基于Aducanumab临床研究遵循药物研发理念中模型引导“学习与确认”原则——即通过已有信息建立模型并预测相关研究结果,然后进一步通过后续实测数据验证模型分析结果的可靠性以及判断后续研究方向,并随着研发过程的推进对模型进行不断更新和完善——美国食品药品监督管理局FDA同意Biogen跳过2期临床试验,直接开展ENGAGE(NCT02477800)和 EMERGE(NCT02484547)两项大型3期临床试验。这两项试验,受试者均按低剂量组(3-6mg/kg目标剂量)、高剂量组(10mg/kg目标剂量)和安慰剂1:1:1进行分组,共治疗78周。这两项临床试验纳入 20个国家的348个分中心,实际入组3,285名符合美国FDA早期阿尔茨海默症3、4期标准的AD患者,1812名受试者(55.2%)完成试验,使用《临床痴呆评分箱(CDR-SB)》评分作为认知和功能评价的主要终点指标,次要指标包括评估认识功能的《简易精神状态检查(MMSE)量表》和《阿尔茨海默病评定量表-认知量表-13项(adas-cog13)》,评估日常活动能力的《阿尔茨海默病合作研究-用于轻度认知功能障碍的日常生活活动(ADCS-ADL-MCI)量表》,评估照顾者对受试者评价的《神经精神量表-10(NPI-10)》,评估大脑中Aβ蛋白和tau蛋白含量用纵向淀粉样蛋白PET成像和纵向tau蛋白PET成像,并采集脑脊液中的Aβ1-42、磷酸化tau-181蛋白(p-tau)和总tau蛋白(t-tau)进行含量评价。
2019年3月Biogen披露了ENGAGE和 EMERGE的中期结果,在改善主要终点指标方面,EMERGE显示出治疗趋势,而ENGAGE未显示出治疗意义,考虑到主要终点指标难以达到统计学意义,Biogen中止了ENGAGE和 EMERGE。
在Aducanumab已经被外界认为失败后,2019年10月Biogen披露了最终3,285名实际入组受试者的试验结果。在改善认知功能的主要终点指标CDR-SB方面,ENGAGE依旧未显示出治疗意义,而EMERGE中的高剂量组显示出显著的治疗意义,与安慰组相比CDR-SB评分减少22%(p=0.01)。评估认识功能和日常活动能力的次要指标MMSE、adas-cog13和ADCS-ADL-MC,以及照顾者对受试者评价的NPI-10,在EMERGE高剂量组中也都得到显著改善。在PET成像方面,无论是ENGAGE还是EMERGE,低、高剂量组的淀粉样蛋白和tau蛋白PET成像都得到显著改善。脑脊液检查显示EMERGE低、高剂量组Aβ1-42显著增加,p-tau和t-tau显著减少,ENGAGE高剂量组Aβ1-42显著增加。在安全性方面,磁共振成像(MRI)显示35.2%的高剂量受试者发生ARIA-水肿(ARIA-E)。
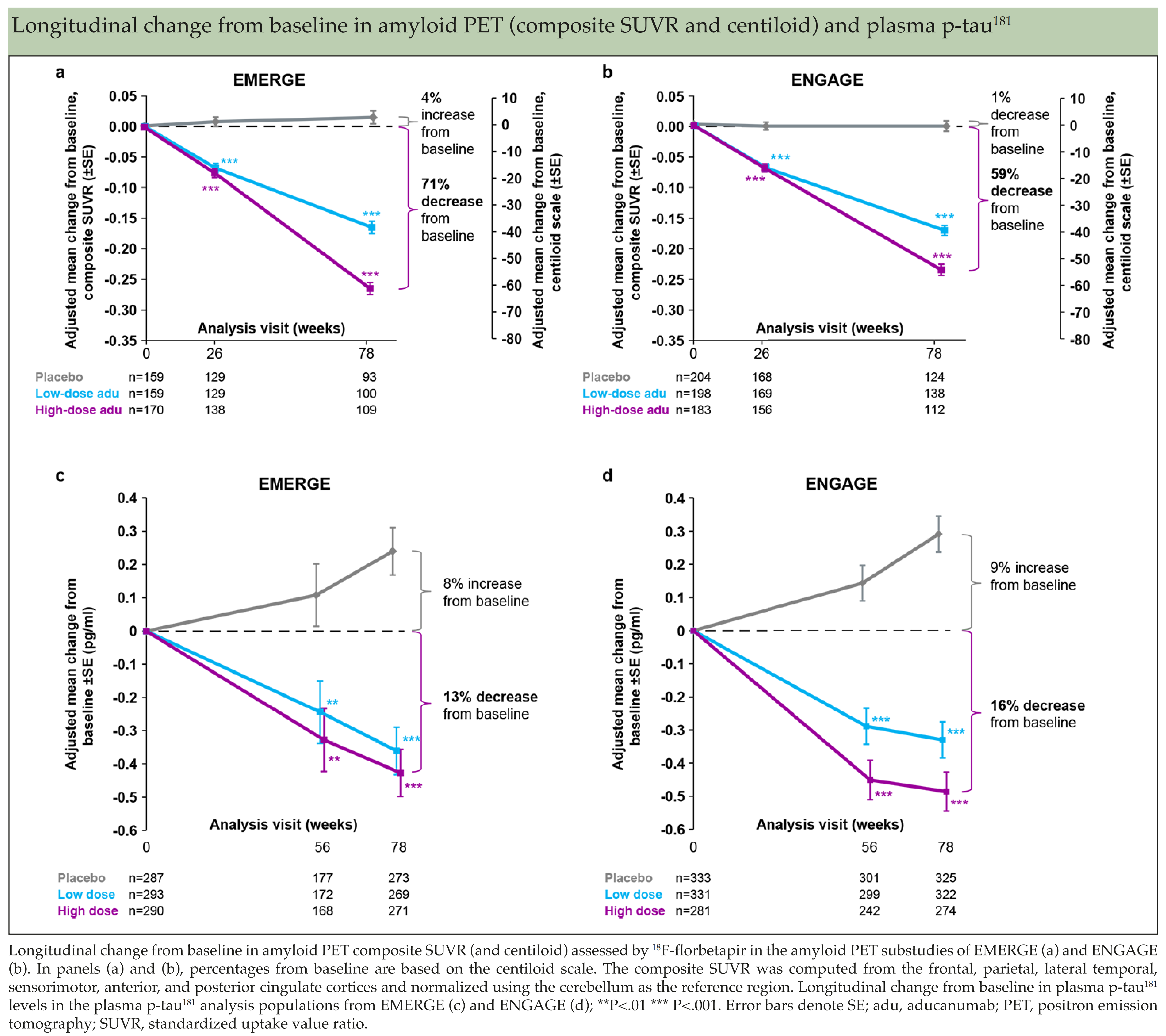
基于上述结果,Biogen向FDA提交Aducanumab的上市申请。FDA咨询委员会审查后,以压倒性票数反对Aducanumab(商品名Aduhelm)上市。2020年12月5日举行的听证会中,英国阿尔茨海默症协会(British Alzheimer's Association)对Aduhelm的有效性表示怀疑,而美国阿尔茨海默症协会(American Alzheimer's Association)强烈建议FDA批准Aduhelm。2021年6月7日基于PET成像上的显著差异,根据可使用生物标志物替代治疗终点的加速批准原则,FDA批准Aduhelm在美国上市。
2024年1月31日渤健(Biogen)宣布调整阿尔茨海默症药物开发管线,停止Aducanumab的开发,并终止Aducanumab的临床试验ENVISION。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3