
多奈单抗(Donanemab)是Eli Lilly礼来开发的抗Aβ单克隆IgG1抗体。目前已完成治疗阿尔茨海默症(AD)的3期临床试验。预计2023年底可获得美国FDA的批准。
结构:

介绍:
多奈单抗(Donanemab,商品名:记能达Kisunla,研发代号LY3002813)是Eli Lilly礼来开发的抗Aβ单克隆IgG1抗体。
早在1995年,日本东京都医学综合研究所的Takaomi C. Saido在2月期《Neuron》发表的论文显示,β淀粉样蛋白多肽Aβp3-42在在阿尔茨海默症(AD)Aβ斑块的早期形成中发挥重要作用(T C Saido et al., 1995)。Aβp3-42是β淀粉样蛋白多肽单体Aβ42的N端被氨基末端蛋白酶切掉2个氨基酸后,第3位的谷氨酸在自发或在谷氨酰环化酶的作用下进行发生焦谷氨酸环化反应生成的N端焦谷氨酸环化Aβ多肽。
考虑到Aβp3-42特异性存在于Aβ斑块,Eli Lilly礼来的Ronald B. DeMattos研究团队尝使用Aβp3-42刺激小鼠来业产生抗体。通后在形成的抗体中反复筛选,DeMattos团队得到鼠源性抗体,并制备而成两种同源的单克隆抗体mE8-IgG1和mE8-IgG2a。mE8能够有效识别Aβp3-x和Aβ斑块,并能减少斑块的体积,但不识别Aβ42单体,对于未发生N端焦谷氨酸环化的Aβ3-x的识别能力也远远差于Aβp3-x。2012年DeMattos将他的研究结果发表在12月期的《Neuron》(Ronald B Demattos et al., 2012)。
在实现mE8的人源化后,Eli Lilly于2013年启动了mE8的人源化抗体LY3002813(IgG1抗体)的1期临床试验,至2016年试验结束。2021年Eli Lilly的Stephen Loucian Lowe在2期《Alzheimer's Dementia》上发表了LY3002813(Donanemab)该临床试验的结果。当Donanemab给药剂量达到10mg/kg时,能够显著减少斑块引起轻度痴呆的轻中度AD患者Aβ斑块( Stephen Loucian Lowe et al., 2021)。
考虑到Donanemab第一项1期临床试验,只有达到10mg/kg时,才能够显著减少AD患者的斑块,Eli Lilly于2015年重新启动1期临床试验,用于初步评价10mg/kg及以上剂量的安全性和有效性。
2017年12月Eli Lilly启动了Donanemab的2期临床试验TRAILBLAZER-ALZ。TRAILBLAZER-ALZ最初包括Donanemab、安慰剂以及Donanemab和β-位点淀粉样前体蛋白裂解酶-1(BACE-1)抑制剂LY3202626联合用药三个试验组。由于LY3202626自身的2期临床试验失败,2018年Eli Lilly中止了联合用药组。Donanemab组和安慰剂最终共内纳入257名早期症状的AD患者。2021年Eli Lilly的Mark A Mintun在5月期《The New England Journal of Medicine》上发表了TRAILBLAZER-ALZ的试验结果。与安慰剂对照组相比,Donanemab(700 mg/4周,连续3次后改为1400 mg/4周,直至第18个月)在治疗终点能够显著有减少主要指标《整合阿尔茨海默病量表( iADRS)》评分下降。同样在减少斑块成像方面,Donanemab也显示出显著的治疗优势。在安全性方面,尽管在治疗终点Donanemab组与安慰剂组相比,大脑海马体的萎缩幅度无显著差异,但大脑总萎缩幅度和脑室体积增幅度,Donanemab组大于安慰剂组(Mark A Mintun et al., 2021)。Donanemab对于脑萎缩的影响,目前还不能确定机制和长期后果。 2020年10月Eli Lilly启动了Donanemab的另一项2期临床试验TRAILBLAZER-ALZ 2,随后Eli Lilly把TRAILBLAZER-ALZ 2扩展成3期临床试验。
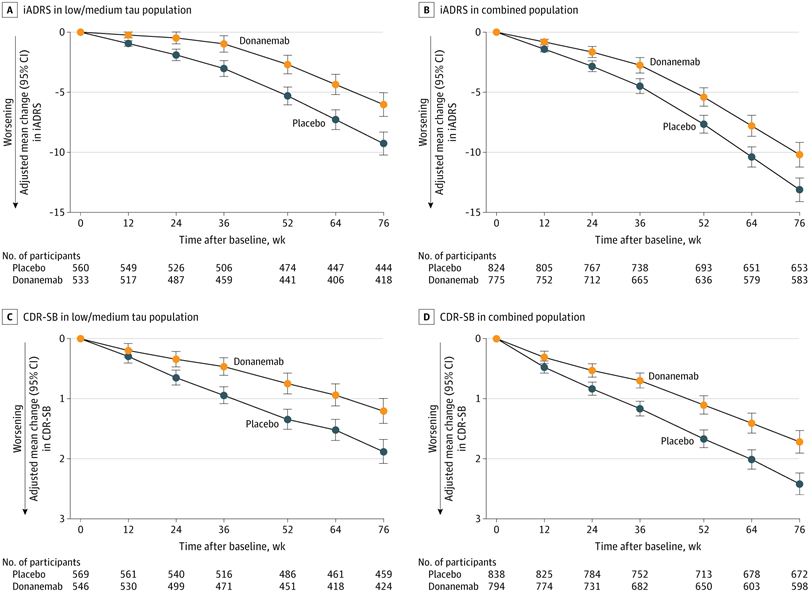
2023年7月17日Eli Lilly公布了TRAILBLAZER-ALZ 2的临床试验结果。该试验共纳入 1736名早期症状的AD患者,其中包括1182名轻中度tau蛋白病理表现和552 名重度tau蛋白病理表现的患者。对于轻中度tau蛋白病理表现患者Donanemab组iADRS评分下降与对照组减少35%,《临床痴呆评分箱(CDR-SB)》评分下降减少36%。对于所有患者Donanemab组iADRS评分下降减少22%,CDR-SB评分下降减少29%。对tau蛋白轻中度病理表现患者进行亚组分析显示,轻度认知障碍患者的iADRS和CDR-SB评分下降幅度分别减少60% 和46%,75岁以下患者的iADRS和CDR-SB评分分别下降幅度分别减少48%和45%。在减少斑块成像成像方面,Donanemab同样也具有显著的治疗优势。在安全性方面,Donanemab组ARIA发生率为36.8%,其中ARIA-H的发生率是31.4 %,无症状ARIA-E的发生率是17.9 %,有症状ARIA-E的发生率是6.1 %。(John R Sims et al., 2023)
2024年7月2日,礼来公司宣布FDA批准Donanemab(商品名Kisunla™)350 mg/20 mL,用于治疗处于轻度痴呆阶段,伴有轻度认知障碍(MCI),并经淀粉样蛋白病理学确诊的成人早期症状性阿尔茨海默病(AD)。Donanemab每四周静脉注射一次,前三剂700mg/次,之后1400mg/次。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

 改变滴定方案礼来降低其阿尔茨海默症抗体药物脑水肿发生率
改变滴定方案礼来降低其阿尔茨海默症抗体药物脑水肿发生率横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3