
乐意保(仑卡奈单抗)是卫材Eisai和渤健Biogen联合开发的抗Aβ单克隆 IgG1抗体。是FDA批准的第一个被证实能够改善认知功能的抗Aβ单克隆抗体药物,也是FDA批准的第一个被证实能够改善认知功能和延缓进展的抗AD药物。
结构:

介绍:
阿尔茨海默症(AD)主要的病理表现为β淀粉样蛋白(Aβ)在神经元外的异常沉积形成的斑块,以及随后发生的Tau蛋白异常磷酸化引起的神经元纤维纠缠。Aβ主要由神经细胞产生,由淀粉样蛋白前体(APP)经分步切割成长度分别含30-51个氨基酸残基的多肽,并释放到细胞外,这些多肽被称为Aβ多肽。最常见的Aβ多肽为Aβ40和Aβ42。Aβ42含42个氨基酸,容易发生聚集,由Aβ多肽单体,聚集形成Aβ寡聚体、Aβ前纤维和Aβ斑块。
2001年瑞典卡罗林斯卡学院(Karolinska Institutet)的Lars Lannfelt研究团队在9月期《Nature neuroscience》上发表了一篇关于“一种致病性APP突变(E693G)”的论文,指出该突变发生在APP基因17号外显子的第693密码子,相对应于将Aβ多肽肽链第22位的谷氨酸(E)替换为甘氨酸(G)。发生该突变后Aβ多肽单体更容易聚集形成Aβ前纤维。
Lannfelt的研究团队利用突变的Aβ多肽(AβE22G)聚集形成的AβE22G前纤维作为抗原刺激小鼠后,分离纯化出抗Aβ单克隆抗体mAb158(鼠源性IgG 2a抗体),mAb158不仅可以识别AβE22G前纤维,也可以识别非突变的Aβ前纤维,并且对于Aβ前纤维的选择性远大于Aβ单体。2003年Lannfelt成立BioArctic以便实现mAb158的人源化以及后续的商业开发。2007年BioArctic和Eisai卫材签定mAb158的人源化抗体BAN2401(IgG1抗体)的共同开发合作协议,2014年Biogen渤健加入到BAN2401的共同开发进程。
1期临床试验显示,BAN2401的耐受性良好,6个剂量组中(0.1mg/kg、0.3mg/kg、1mg/kg、10mg/kg、15mg/kg)仅0.3mg和1mg剂量组中各出现1例无症状的淀粉样蛋白相关成像异常-出血(ARIA-H)。2b期床试验,BAN2401的5个剂量组在淀粉样蛋白生物指标PET成像方面都取得显著的优势。尽管在改善终点主要指标《阿尔茨海默病综合评分(ADCOMS)》减分方面并未达到“缓解率超过25%的概率达到80%”的预设标准,但考虑到10mg/kg/两周剂量组在ADCOMS治疗终点方面取得显著优于安慰剂对照组的成绩。Eisai和Biogen积极推进BAN2401按10mg/kg/两周的使用剂量进入3期临床试验。
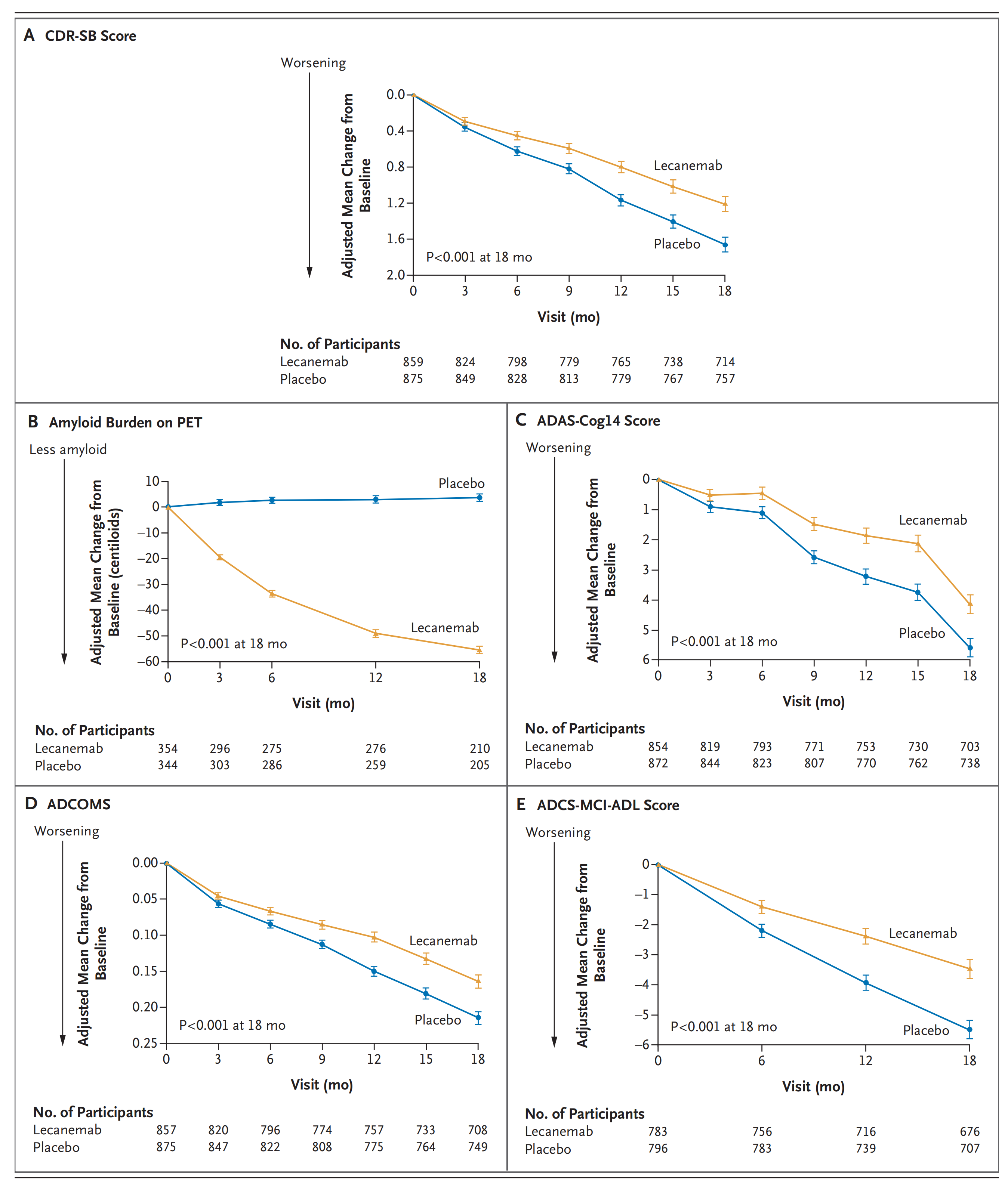
2022年9月28日Eisai和Biogen共同公布了Lecanemab(BAN2401)的3期临床试验 Clarity AD的试验结果。Clarity AD临床试验共纳入1795名轻度认知障碍或轻度痴呆的AD患者,按Lecanemab治疗组10mg/kg/两周剂量组和安慰剂对照组1:1分组。在改善主要指标《临床痴呆评分箱(CDR-SB)》评分变化方面,治疗终点第18个月,Lecanemab组评分与安慰剂对照组相比变化幅度减少27%。次要指标PET成像、ADCOMS、《阿尔茨海默病评定量表-认知量表-14项(ADAS-cog14)》、《阿尔茨海默病合作研究-用于轻度认知功能障碍的日常生活活动(ADCS-ADL-MCI)量表》Lecanemab组与安慰剂组相比也取得显著的治疗优势。在安全性方面,Lecanemab组ARIA-H的发生率为17.3%,ARIA-E的发生率为12.6%。
2023年1月6日美国FDA依据加速审批程序,批准Leqembi(Lecanemab)用于治疗AD。2023年6月9日FDA咨询委员会投票一致认可Leqembi能够给AD患者带来治疗收益。 2023年7月6日FDA完全审批Leqembi治疗AD。Leqembi是FDA批准的第一个被证实能够改善认知功能的抗Aβ单克隆抗体药物,也是FDA批准的第一个被证实能够改善认知功能和延缓进展的抗AD药物。
2024年1月9日,中国上海——卫材(中国)药业有限公司宣布乐意保(Leqembi)®(仑卡奈单抗Lecanemab)获国家药品监督管理局(NMPA)批准正式进入中国。
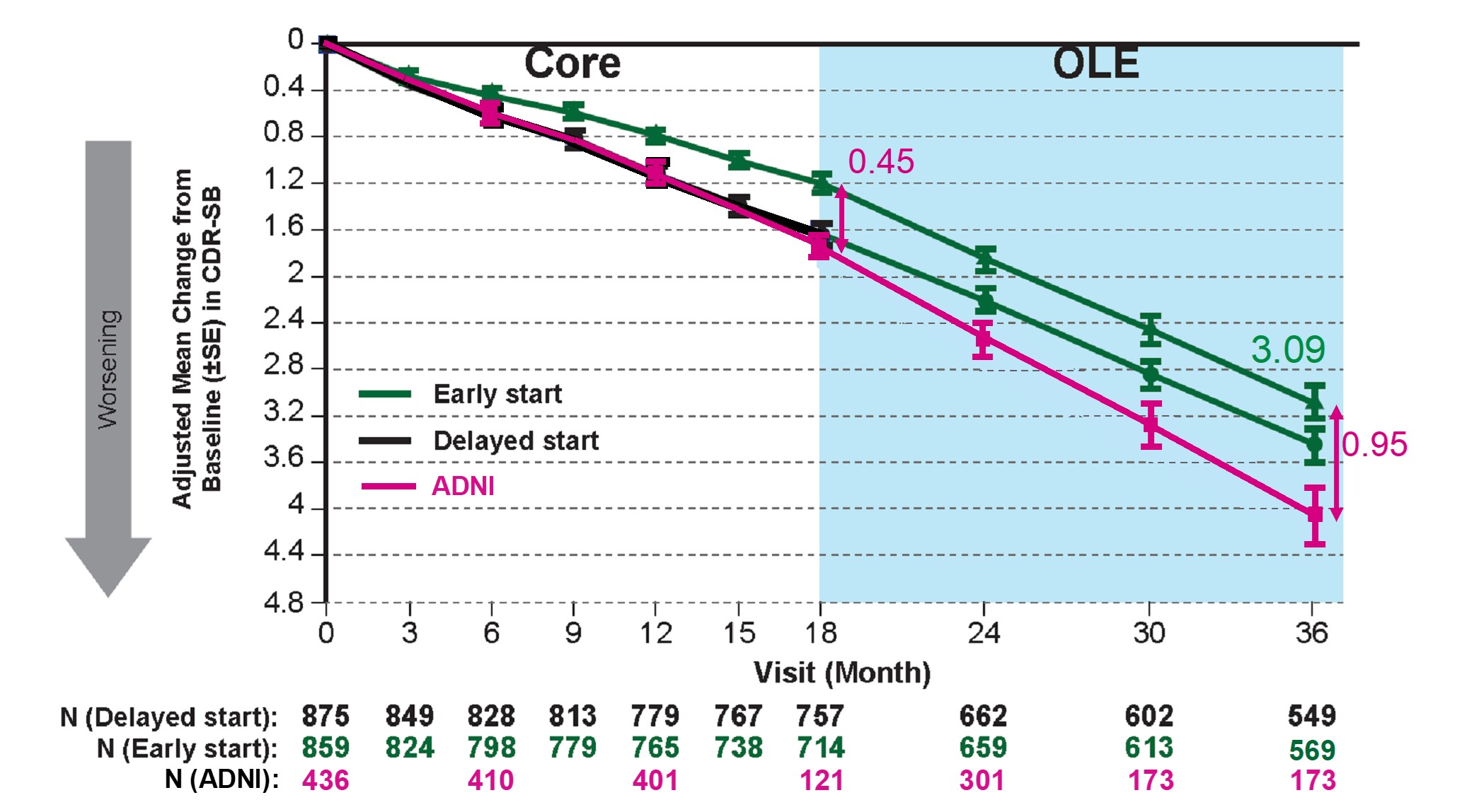
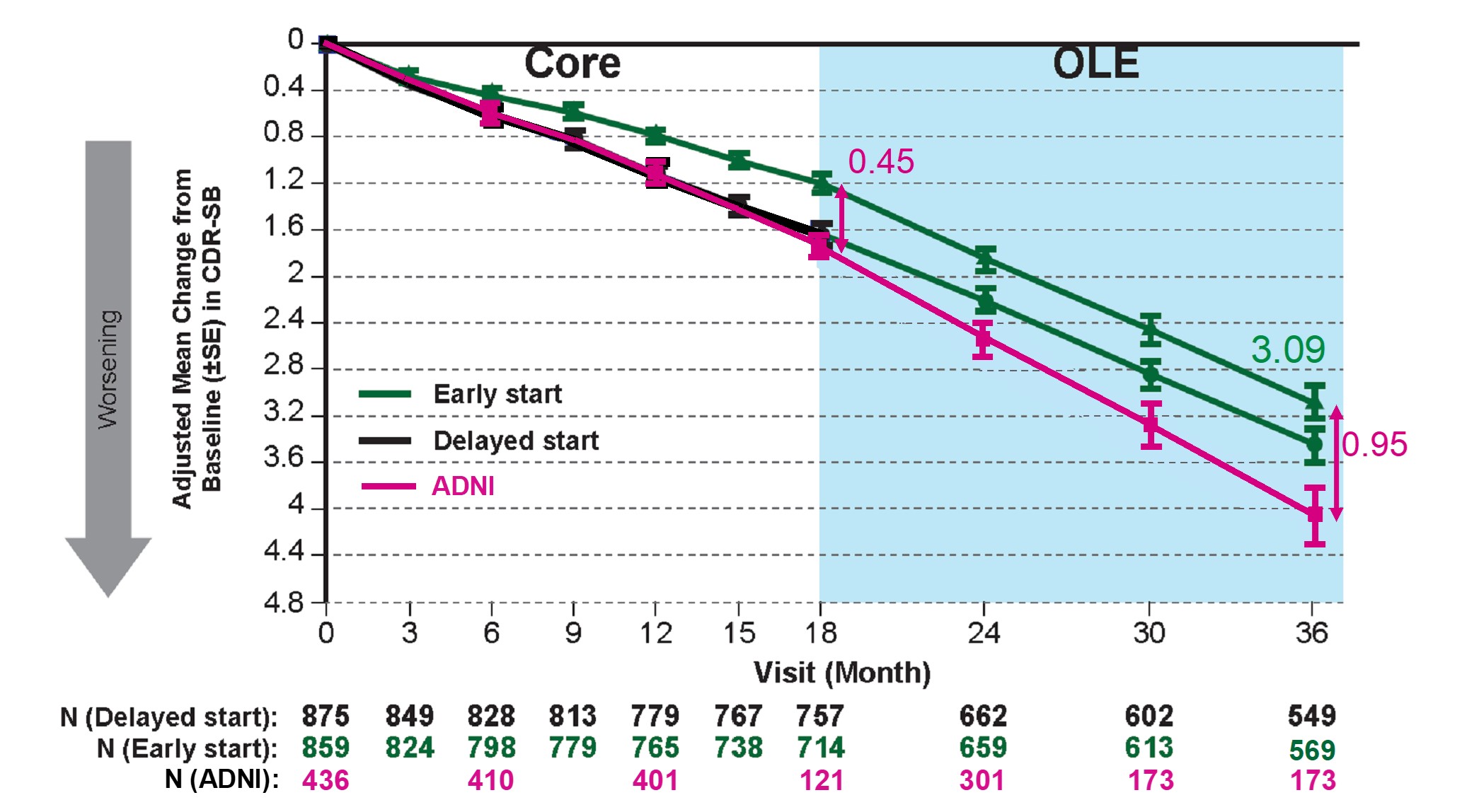
2024年7月30 日日本卫材株式会社(Eisai Co., Ltd.)和渤健(Biogen Inc.)宣布,在阿尔茨海默病协会国际会议(AAIC)2024年年会上公布抗β淀粉样蛋白(Aβ)单克隆抗体仑卡奈单抗(乐意保LEQEMBI)治疗早期阿尔茨海默病(AD)最新研究结果。1.经过仑卡奈单抗治疗3年,早期AD患者《临床痴呆评分箱(CDR-SB)》评分临床衰退幅度减少0.95分。该结果基于Clarity AD临床试验开放标签扩展研究数据。Clarity AD是一项全球3期随机、双盲、平行列队、安慰剂对照对研究,共纳入1,795名早期AD患者。随机接受仑卡奈单抗(898 人,10 mg/kg,每两周静脉注射一次)或安慰剂(897 人)进行治疗。在完成18个月核心研究(Core)阶段后,95%的患者选择进入开放标签扩展研究(OLE)。在核心研究阶段仑卡奈单抗组与安慰剂组相比CDR-SB评分相对于基线,临床衰退幅度减少0.45分。经过核心研究阶段和开放标签扩展研究阶段共3年治疗,仑卡奈单抗组与既往试验研究(阿尔茨海默病神经影像学倡议ADNI研究)对照组相比临床衰退幅度减少0.95分。0.5至1分相当于某一项认知能力(如记忆、社区事务、家庭/爱好)从轻微损伤到丧失独立完成能力。2.经过仑卡奈单抗治疗3年,59%(24/41)患者CDR-SB评分得到改善或没有恶化,51%(21/41)患者CDR-SB评分与基线相比得到改善。反映在《阿尔茨海默病评定量表-认知量表-14项(ADAS-cog14)》评分上,63%患者得到改善或没有恶化,61%患者得到改善。同样反映在《阿尔茨海默病合作研究-用于轻度认知功能障碍的日常生活活动(ADCS-ADL-MCI)量表》》评分上,63%患者得到改善或没有恶化,59%患者得到改善。3.在斑块清除后,停止治疗后 AD 仍会继续进展。该结果基于201研究开放标签扩展研究数据。201是一项多中心、双盲、安慰剂对照2b期临床试验,共纳入856名早期AD患者。 在18个月核心研究阶段之后经过9-59个月(平均24 个月)的停药期后,进入开放标签扩展研究阶段。在停药期间,尽管仑卡奈单抗的临床效果得以持续,但仑卡奈单抗组CDR-SB评分恶化率(斜率)变成与安慰剂组评分恶化率(斜率)相似。说明,即使Aβ斑块被清除,AD仍会继续进展。4.此外,上述两项试验显示半数AD生物标志物Aβ42/40比率、pTau181和GFAP的阳性结果分别在治疗的第0.5年、1.6年和1.7年消失。当停止治疗后 Aβ42/40 比率、pTau181、pTau217 和 GFAP能够恢复至阳性(Eisai., 2024)。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3