目前针对动脉粥样硬化性心血管疾病(ASCVD)干预的方法,主要通过抑制胆固醇合成、吸收等,使肝细胞通过细胞表面的低密度脂蛋白(LDL)受体从血液中回收更多的LDL,降低ASCVD的发生风险。
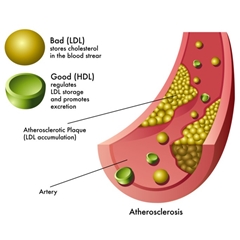
动脉粥样硬化是引起冠心病、心绞痛、心肌梗死等动脉粥样硬化性心血管疾病(ASCVD)的主要原因。
尽管CT扫描显示生于5300年前的冰冻木乃伊“Ötzi”,在生前患有动脉粥样硬化。但首次记录动脉上粥样化斑块的是10世纪阿拉伯医生Avicenna。受古希腊希波克拉底(Hippocrates)体液学说影响,Avicenna认为动脉壁的这种异常是由异常黑胆汁沉积的结果。直到1804年意大利人Antonio Scarpa在他的动脉瘤专著中才首次在欧洲详细记录了动脉壁上的这种变化。

引入动脉硬化(Aarteriosclerosis)一词的是德国人Jean Fredéric Lobstein。其在 1833年出版的专著《Traité d’anatomie pathologique病理解剖学论著》用Aarteriosclerosis一词泛指各种类型的动脉硬化。而动脉粥样硬化(Atherosclerosis)一词由德国人Felix Marchand于1904年引入,以强调病变部位中存在脂质物质,并导致血管硬化和阻塞。
19世纪中叶,对动脉粥样硬化的形成机制做了早期探讨,并对动脉粥样硬化中的炎症反应有了早期认识。德国人Rudolf Virchow强调炎症在动脉粥样硬化的发生中发挥主要作用,认为是动脉壁损伤后引起的慢性炎症反应,并不是简单的血栓附着或脂质沉积。而奥地利人Carlvon Rokitansky倾向于炎症是继发于动脉粥样硬化之后的病变表现。
20世纪初,发现胆固醇参与动脉粥样硬化的的病理发展过程,把动脉粥样硬化的治疗引入降脂领域。
胆固醇由法国人Poulletier Salle发现。1769年Salle从胆结石中分离出一种固体的脂质类物质,也就是胆固醇。1789年法国人Antoine Fourcroy提纯得到胆固醇结晶。1815年法国人Michel Chevreul将胆结石中这种脂质固体,称为Cholesterine,源于hole(胆汁)、Stereos(固体)和Glycerine(甘油)。1859年法国人Berthelot认为胆固醇是一种醇(Alcohol)类物质,因此改称Cholesterol。此后在脂肪、肌肉、牛奶、血液中都发现含有胆固醇。
1907年俄罗斯人Alexander Ignatowski用全脂牛奶、鸡蛋和肉类食物喂食兔子,成功使兔子出现动脉粥样硬化。1910年德国人Adolf Windaus发现动脉粥样斑块中游离胆固醇和酯化胆固醇的含量分别是正常动脉壁的6倍和20倍。1913年俄罗斯人Nikolai Anichkovet用不含蛋白质的纯胆固醇喂食兔子,就使兔子出现动脉粥样硬化,Anichkovet还发现病变最早出现在主动脉弓,以及在病变部位出现富含有胆固醇的空泡化细胞(泡沫细胞)。Anichkov准确描述了在动脉粥样硬化病变中发现的巨噬细胞、淋巴细胞等炎症细胞,将胆固醇和炎症反应联系在一起。
尽管 Ignatowsk、Windaus和Anichkov将动脉粥样硬化与脂质联系在一起,但由于狗和大鼠实验未能引起类似的反应,并且在临床实践并非所有高血胆固醇的个体都会出现心血管疾病,以及当时血胆固醇上限标准远高于目前的理想标准使得错误认为大多数动脉粥样硬化患者的胆固醇水平处于“正常”值,这都使当时对于动脉粥样硬化的脂质假说持怀疑态度。1938年挪威人Carl Müller首次发现了家族性高胆固醇血症,指出这类患者具有高心血管意外死亡风险,并建议患者避免食用蛋黄、黄油、奶油、全脂牛奶或动物脂肪等富含脂质和胆固醇的食物,Müller使人们认识到胆固醇能够增加心脏病发作的发生率。
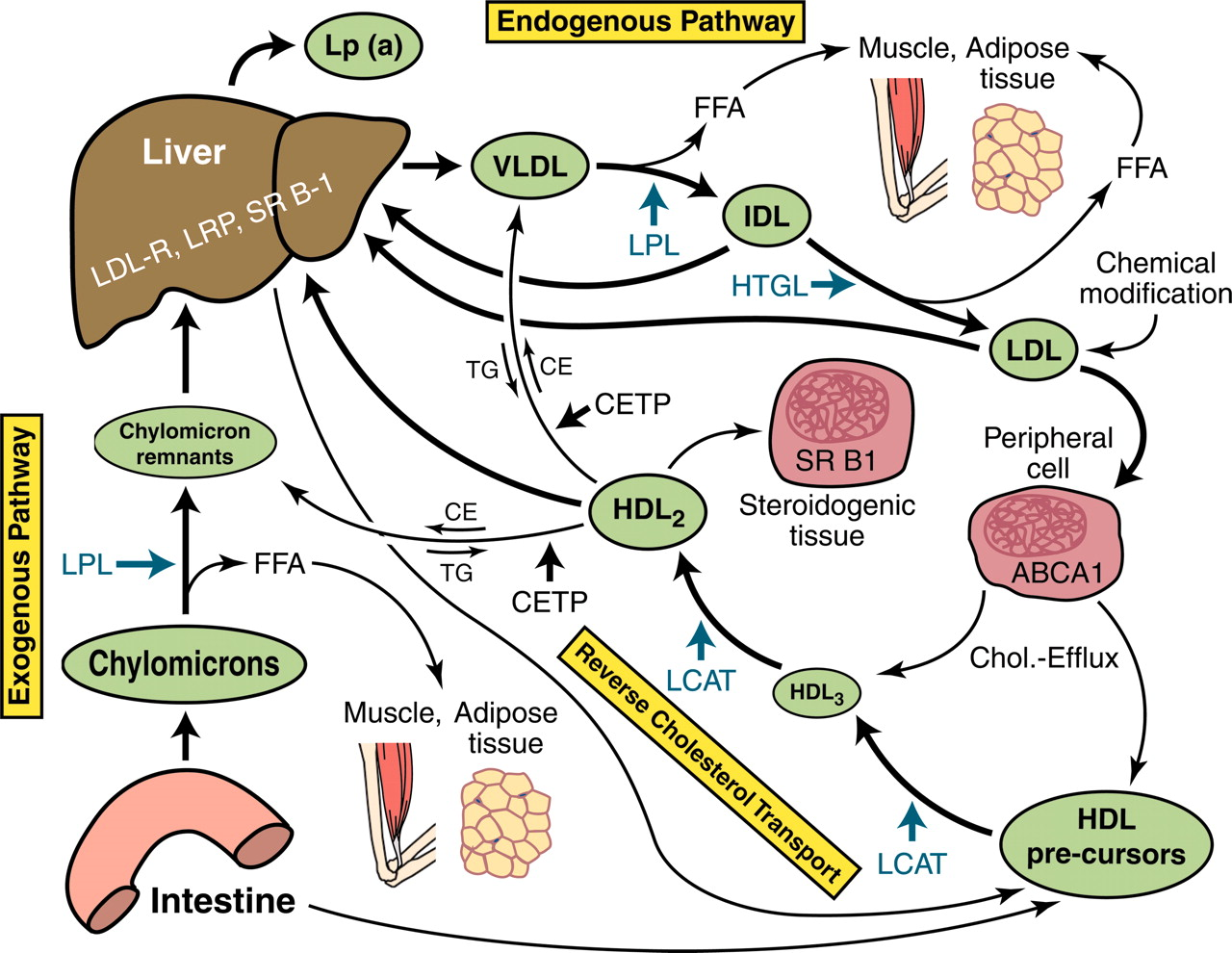
血液中胆固醇除了以游离的形式存在之外,更多的是以脂蛋白的形成存在,而脂蛋白的发现,把对于动脉粥样硬化形成机制的研究再向前推进一步。
1924年美国康奈尔大学(Cornell University)的Gage和Fish把脂肪餐后血液中出现的体积较大的微粒称之的乳糜微粒(Chylomicron,CM)。1929年的法国到巴黎巴斯德学院(Pasteur Institute)的Machebouef研究表明脂质不是游离存在于血液当中,而是与蛋白质、磷脂、胆固醇组成复合物,并使用盐沉淀技术分离出一种富含脂质的球蛋白(α球蛋白)。1934年瑞典乌普萨拉大学(Uppsala University)的Arthur McFarlane通过超速离心技术,发现血清在A组分(白蛋白)和G组分(球蛋白)之间存在一种未被分离的组分,称之为X蛋白。1941年乌普萨拉大学的Gunnar Blix等人使用电泳法将血清蛋白分为白蛋白、α球蛋白、β球蛋白和γ球蛋白,化学分析表明α和β球蛋白中含有较高的磷脂和胆固醇,因此也被称之为α脂蛋白和β脂蛋白,按照密度不同α脂蛋白也被称为高密度脂蛋白(HDL),β脂蛋白被也称为低密度脂蛋白(LDL)。1947年乌普萨拉大学的Kai Pedersen在McFarlane超速离心技术的基础上通过给定盐溶液浓度,改变血清在盐溶液中的浓度,成功将X蛋白分离,测得X蛋白的密度接近于1,并确定X蛋白为β球蛋白。
1949年美国加利福尼亚大学(University of California)Donner实验室的John Gofman和他的学生Frank Lindgren,通过在超速离心技术中使用不同密度的盐溶液,将不同密度的LDL进一步分离。由于彼此的界限不明显,Gofman和Lindgren使用沉降系数(Sf)对不同密度的LDL进行区分。在区分LDL后,Gofman和Lindgren将该项技术用于测定喂食胆固醇诱导兔子发生动脉粥样硬化病变过程中低密度脂蛋白变化分布情况。Gofman和Lindgren发现出现动脉粥样硬化病变兔子的沉降系数为Sf10-30的LDL水平明显高于未发生动脉粥样硬化病变兔子,他们通过对107例既往发生心肌梗死患者进行检测,进一步发现既往发生过心肌梗死的患者沉降系数为Sf10--20的LDL水平明显升高。1950年他们在2月期《Science》发表了上述研究结果。同年在8月《Circulation》,他们指出通过严格饮食控制能够降低Sf10--20低密度脂蛋白水平。1951年Gofman和Lindgren在1月《The Journal of Physical and Colloid Chemistry》上发表了扩大人群的检测结果。对超过6000例个体进行检测的结果同样显示既往心肌梗死患者的Sf10--20低密度脂蛋白水平高于正常个体。美国国立卫生研究院(National Institutes of Health)在Gofman的推动下,开展了一项多中心的大规模临床研究,由于未能证实Sf10--20脂蛋白比胆固醇更能够预测ASCVD风险,并且超速离心技术设备及检测人员还未普及,Sf10--20低密度脂蛋白检测的意义受到质疑。此后越来越多的证据表明血清LDL水平与ASCVD发生风险密切相关,检测低密度脂蛋白胆固醇(LDL-C)水平成为ASCVD抗脂治疗最主要的指标。
关于LDL与ASCVD之间的关系,早在1913年Anichkovet就注意到实验兔子在血管内皮下出现的动脉粥样硬化斑块中聚集富含胆固醇的泡沫细胞。后续的一系列研究发现这些沫细胞主要巨噬细胞和血管平滑肌细胞转变而来。在出现血管内皮损伤后,含有胆固醇的巨噬细胞会进入血管内皮,并一步积累胆固醇形成泡沫细胞。由形成巨噬细胞形成的泡沫细会并促进周围的平滑肌细胞在细胞内积聚胆固醇,最终也转变为泡沫细胞。学者们最初推测巨噬细胞会吞噬LDL。但1964年当澳大利亚阿德莱德大学(The University of Adelaide)A J Day等人将含有H3标记的脂蛋白加入的巨噬细胞溶液,却发现巨噬细胞几乎不会吞噬脂蛋白,在巨噬细胞内仅检测到微量H3标记的胆固醇。巨噬细胞极低的脂蛋白吸收效率与能够形成富集胆固醇的泡沫细胞之间存在巨大的差异。1974年美国得克萨斯大学西南分校(University of Texas Southwestern)的Joseph Goldstein和Michael Brown在研究家族性高胆固醇血症过程中发现低密度脂蛋白(LDL)受体。LDL受体广泛分布于全身各组织,能够与LDL结合,通过胞饮作用把LDL带入细胞,使LDL携带的胆固醇被细胞利用。Goldstein和Brown发现巨噬细胞似乎缺乏LDL受体,验证了 Day等人在1964年的发现。那么泡沫细胞的中胆固醇由何而来?考虑到巨噬细胞的主要作用是吞噬异物,1979年Goldstein和Brown使用变性LDL——由(125)I标记的乙酰基-LDL做为探针,对巨噬细胞的吞噬功能进行测定。结果显示巨噬细胞对于变性LDL的吞噬能力远大于正常的LDL。原来巨噬细胞吃掉的是不正常的LDL。
Goldstein和Brown的发现为揭开动脉粥样硬化斑块的形成机制奠定了基础。LDL能够把胆固醇输送到全身各处,通过细胞上LDL胆固醇受体为组织所利用。当血管内皮发生损伤后,巨噬细胞会进入血管内皮。在氧化应激的条件下,LDL发生脂质过氧化反应,转变为变性的氧化修饰低密度脂蛋白Ox-LDL。Ox-LD被巨噬细胞上清道夫受体(包括LOX-1、SR-A1、CD36 和 SR-B1)识别后,通过胞饮作用被巨噬细胞吞噬,进入溶酶体进行降解。降解后的胆固醇会以游离形式通过ABCA1转运蛋白外排进入循环,并由高密度脂蛋白(HDL)带回肝脏代谢。巨噬细胞内超过转运蛋白处理能力剩余的胆固醇,可在内质网 (ER)中再次酯化为胆固醇脂肪酸酯,以脂滴形式存储在胞浆中,当脂滴不断在巨噬细胞中积累,巨噬细胞最终转变为泡沫细胞。巨噬细胞形成的泡沫细胞,还能够刺激周围的血管平滑肌细胞通过LDL受体吸收LDL,也形成泡沫细胞,泡沫细胞还介导了血管内皮发生炎症反应,导致进一步损伤。
在美国国立卫生研究院(National Institutes of Health)的Richard Havel将脂蛋白分成HDL、LDL和极低密度脂蛋白(VLDL)三类之前。脂蛋白一直被简单分为二类,密度> 1.063g/ml的HDL和密度<1.063g/ml的LDL。 1955年Havel等人经过反复超速离心提取,发现LDL可以进一步按密度分成两个检测峰,1.019-1.063g/ml的LDL和< 1.019g/ml的极低密度脂蛋白(VLDL)。1967年美国佛罗里达大学(University of Florida)的Melvin Fried通过超速离心分析多种动物的血清样本,发现在LDL和HDL之间还在一个小的检测峰,称之为中密度脂蛋白(IDL)。由于IDL的密度为1.006-1.019g/ml,因此VLDL目前特指密度<1.006g/ml的脂蛋白。从1950s年开始对脂蛋白中载脂蛋白的类型进行化学分析,及1960s核磁共振分析技术的引入,逐渐明确了乳糜微粒、VLDL、IDL、LDL、HDL的组成和结构。从组成上看,脂蛋白主要包括胆固醇、载脂蛋白、磷酯和甘油三酯。由于各组份的比例不同,及载脂蛋白的亚型不同,决定了各种脂蛋白的密度和体积。除了CM、VLDL、IDL、LDL和HDL之外,1963年挪威奥斯陆(Rikshospitalet)大学的Kåre Berg在研究脂蛋白抗体的过程中发现脂蛋白 Lp(a)。从结构上看 Lp(a)是在LDL的基础上与载脂蛋白A(ApoA)结合而成。
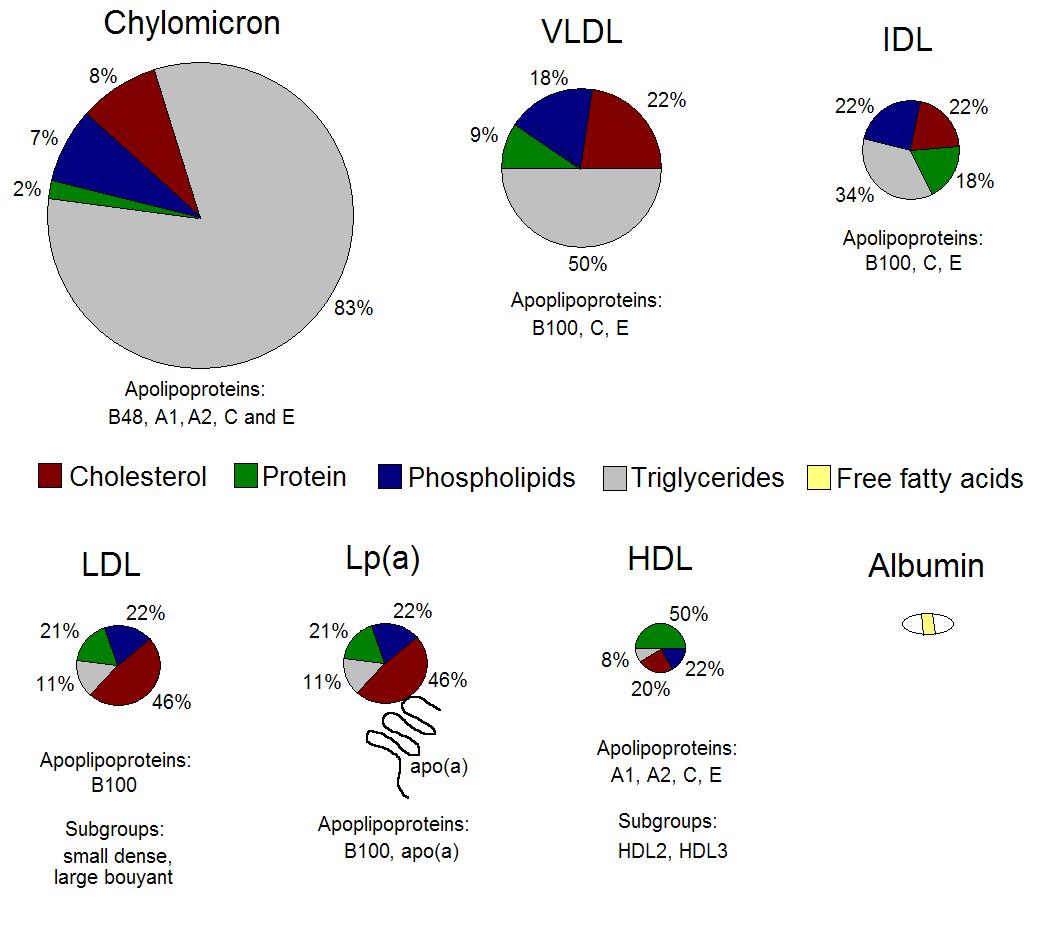
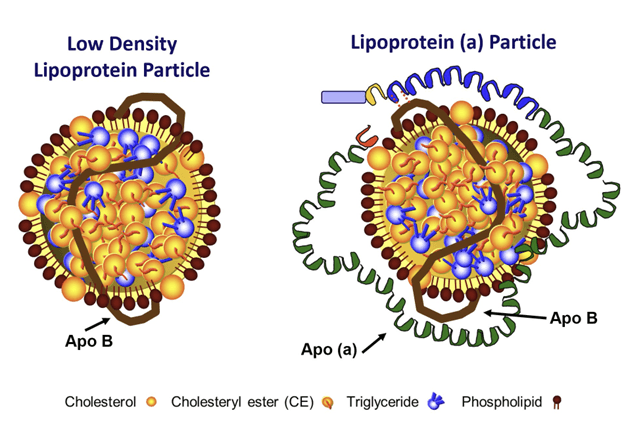
Lp(a)密度为1.050-1.080g/ml。与LDL相类似Lp(a)也被认为能够预测ASCVD的发生风险。最早将Lp(a)与心血管疾病联系在一起的是瑞典博登(Boden)中心医院 的Dahlén。1972年Dahlén通过电泳检测血清样本时发现多个心绞痛患者表现出明显的Lp(a)检测带。之后的多个研究肯定了Lp(a)对于心血管疾病的影响。由于Lp(a)上载脂蛋白(A)长度的变化较大,因此对于Lp(a)测定结果均在一定的偏差,导致是否对于ASCVD具有影响存在争议。2022年美国心脏学会(American Heart Association)发表关于Lp(a)的科学陈述,客观论证了Lp(a)是ASCVD独立且有因果关系的风险因素,为降低Lp(a)药物的开发提供了重要依据。
与LDL和Lp(a)不同,HDL上升被认为能够降低ASCVD风险。与LDL能够把胆固醇输送到全身各处相反,HDL把外周的胆固醇带回肝脏。肝脏能够选择性地从HDL颗粒中去除胆固醇,形成脂质贫乏的HDL。多余的胆固醇被排泄到胆汁中,而脂质贫乏的HDL被降解或返回循环进行再次利用。20世纪70至80年代,多项临床试验显示HDL降低是ASCVD的一个强而独立的危险因素。
另外一个被认为能够预测ASCVD风险的是载脂蛋白B(ApoB)。ApoB分为两种ApoB48和ApoB100。ApoB48存在于CM中,含有ApoB100的包括VLDL、IDL、LDL、Lp(a),各含一分子的ApoB100。检测ApoB,通常指的是ApoB100。VLDL由肝脏产生,负责把肝脏甘油三酯的带给其它组织利用,在脂蛋白脂酶(LPL)作用下释放出游离的甘油三酯后转变为IDL,IDL在肝甘油三酯脂肪酶(HTGL)的作用下释放甘油三酯,并转变为LDL。由于VLDL和IDL都会转化为LDL,并且Lp(a)也含有ApoB100,因此有研究认为通过检测ApoB比检测LDL-C更有助于预测ASCVD风险。
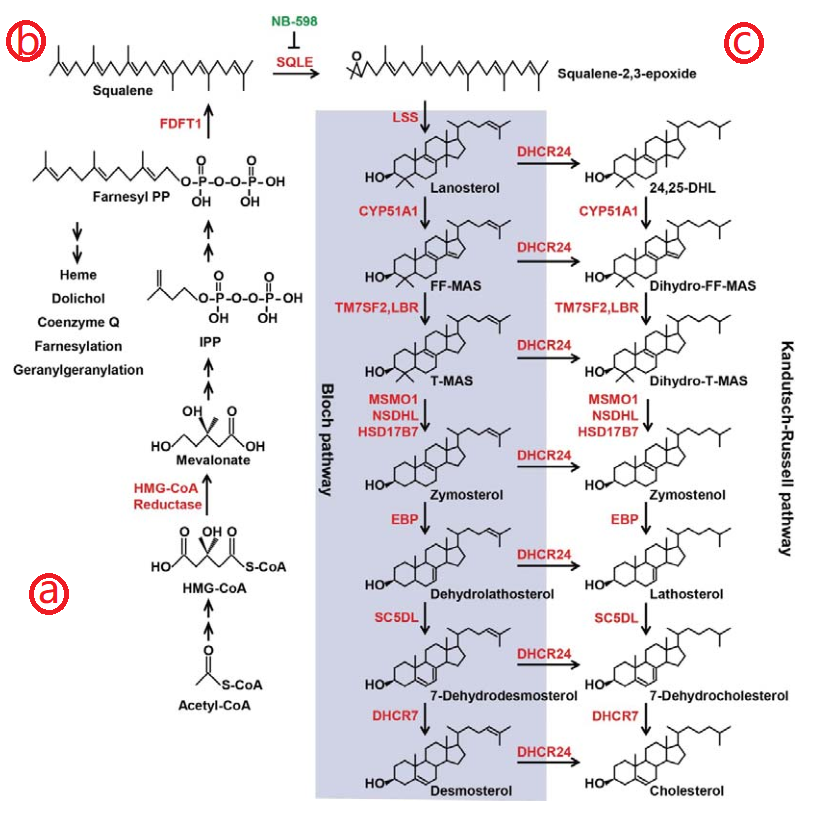
二十世纪50年代Konrad Bloch、Feodor Lynen、John Cornforth和George Popják阐明了胆固醇在体内合成的途径。可大致归结为3个阶段,a.由3个乙酰辅酶A(Acetyl-CoA)合成甲羟戊酸盐(Mevalonate);b.由甲羟戊酸盐转化缩合形成含30个碳链的角鲨烯(Squalene);c.角鲨烯环化转化最终形成胆固醇。其中第一阶段在羟甲戊二酰辅酶A(HMG-CoA)还原酶的作用下完成,第三阶段在24-去羟基甾醇还原酶(DHCR24)的作用下完成。HMG-CoA和DHCR24是胆固醇在体内合成的限速酶。体内胆固醇的来源以内源性为主,由肝脏合成,食物来源仅占一小部份,因此抑制HMG-CoA或DHCR24,可以显著降低胆固醇水平。
第一个被发现具有降低胆固醇作用的是烟酸(Niacin)。烟酸于1868年由Huber首先合,为尼古丁(Nicotine)的氧化产物。起初烟酸主要用于显像,后在酵母和谷物中发现含有烟酸。1937年Conrad Elvehjem发现烟酸对某些皮肤粗糙患者具有疗效。该类皮肤粗糙之后被证实是由于缺乏核黄素(Riboflavin)引起,烟酸和核心黄素都同属B族维生素。1954年加拿大萨斯喀彻温大学(University of Saskatchewan)的Rudolf Altschul发现烟酸可以降低胆固醇。60年代的研究显示烟酸能够抑制脂肪组织动员,新的研究显示烟酸可以促进ABCA1转运蛋白的表达。烟酸既能够降低LDL-C,也能降低甘油三酯,与目前普遍使用的他汀类药物相比其降低LDL-C的作用较弱。
另一个早期使用降低胆固醇药物是氯贝丁酯,属于贝特类药物。1954年Cottet发现法国克莱蒙费朗(Clermont-Ferrand)地区的农民,在使用英国帝国化学工业(Imperial Chemical Industries,ICI)开发的杀虫剂后,体内胆固醇水平较低。ICI在其杀虫剂的基础上得到氯贝丁酯。1958年氯贝丁酯(Clofibrate)在英国上市。氯贝丁酯能够显著降低甘油三酯,但降低LDL-C的作用较弱。世卫组织(WHO)于1964年启动了一项纳入15 745名30-59岁的男性,平均治疗5.3年的大型临床研究。结果显示尽管氯贝丁酯能够降低非致死性心肌梗死的发生率,但不降低致死性心肌梗死的发生率。后续开发的贝特类药物包括吉非罗齐(Gemfibrozil)、苯扎贝特(Bezafibrate)和非诺贝特(Fenofibrate)。
1959年在美国上市了第一个影响胆固醇体内合成的药物曲帕拉醇(Triparanol,MER/29),曲帕拉醇是DHCR24的抑制剂。上市后不久,由于发现可引起白内障,曲帕拉醇于1962年退出市场。
在1970s他汀类药物出现前,最有效降低胆固醇的药物是胆酸螯合剂,为阴离子交换树脂,可阻断肠道内胆固醇的重吸收,产生降低血清胆固醇的作用。1960年David Tennent通过动物实验发现阴离子交换树脂考来烯胺能够降低胆固醇。考来烯胺由陶氏化学(Dow Chemical Company)开发,原用于软化水质,该药于1973年获得FDA批准于美国上市。1984年美国国家卫生研究院(National Institutes of Health)的Rifkind在《The American journal of cardiology》发表了考来烯胺对于致死性冠心病或非致死性心肌梗死发生风险影响的多中心临床试验LRC-CPPT的研究结果。LRC-CPPT共纳入3,806 名元症状的中年男性原发性高胆固醇血症患者,平均接受考来烯胺或安慰剂治疗7.3年。结果显示与安慰剂组相比,考来烯胺用药物组总胆固醇(TC)和LDL-C分别降低13.4%和20.3%,终点事件的发生率减少19%。尽管LRC-CPPT试验验证了考来烯胺在预防ASCVD方面的意义,但治疗组和对照组终点事件的发生率方面的差异差一点就没有达到统计学上的意义。胆酸螯合剂类药物还包括考来替泊(Colestipol)和考来维仑(Colesevelam)。
1970s陶氏化学还开发了另一种将低胆固醇的药物——普罗布考(Probucol)。普罗布考于1970年由陶氏化学的James Barnhart在筛选降胆固醇药物时发现。普罗布考是联合煤业公司(Consolidation Coal Company)开发的一种抗氧剂。陶氏化学最初引进普罗布考的目的是将其做为抗氧剂用于橡胶生产。该药于1977年获得FDA批准于美国上市。由于发现普罗布考能够引起QT间期延长和室性心律失常,并能够将低HDL-C,于1995年从美国退市。
尽管在1950年代,就已经阐明胆固醇体内合成的机制,但开发影响体内合成胆固醇的药物却并不顺利。第一个影响胆固醇体内合成的药物曲帕拉醇(Triparanol,MER/29),是DHCR24的抑制剂,于1959年在美国上市。由于发现可引起白内障,曲帕拉醇于1962年退出市场。而另一种影响体内合成胆固醇的药物HMG-CoA还原酶抑制剂,直到15年后,才于1987年在美国上市。
从1971年开始日本三共(Sankyo)制药的远藤章(Akira Endo)开始从微生物的培养物中寻找能够抑制HMG-CoA还原酶的物质。1972年在筛选超过3800种真菌后,远藤章发现桔青霉分泌的的桔青霉素(Citrinin)能够抑制HMG-CoA还原酶。之后远藤章重点在各种桔青霉菌株中筛选有望实际药用的HMG-CoA还原酶抑制剂。1972年夏天,远藤章发现京都一家粮仓大米样本所含的桔青霉(Penicillium citrinum)株可以产生抑制HMG-CoA还原酶的物质。1973年7月远藤章从中分离出三种活性成分,并选择其中活性最强的成分(Compactin,研发编号为ML-236B)开展进一步研究。通过对比ML-236B和HMG-CoA的未端结构,远藤章推测ML-236B通过竞争性抑制HMG-CoA还原酶发挥作用。尽管细胞实验显示ML-236B能够显著抑制HMG-CoA还原酶,但在大鼠7天喂食胆固醇实验中却未能够见到降胆固醇实现显著降低。通过比每天的数据,远藤章发现ML-236B之所以对大鼠无效是因为ML-236B诱导大鼠表达HMG-CoA还原酶,抵消了ML-236B的降胆固醇作用。由于在其它物种鸡、狗和猴子实验中未见到这种诱导现象,ML-236B于1978年首次在临床进行尝试性使用——日本大阪大学医院的Akira Yamamoto使用ML-236B尝试治疗了一例严重家族性高胆固醇血症患者。该患者血清胆固醇水平从1000mg/dl下降到700mg/dl,在用药2周后出现可逆性转氨酶升高及肌损害。1980年 Yamamoto发表了ML-236B的早期人体试验结果。11例原发性高胆固醇血症患者使用ML-236B给药剂量为50--150 mg/天,治疗 4--8周后,杂合子家族性高胆固醇症和混合性高脂血症患者血清胆固醇水平降低27%。1980年8月在100mg和200 mg/kg/天狗的高剂量组长期实验中,由于出现淋巴瘤,三共紧急叫停了ML-236B已经开展的2期临床试验。尽管在20 mg/kg/天狗长期安全性试验中未观察到这种致癌作用,三共还是完全停止了ML-236B项目。
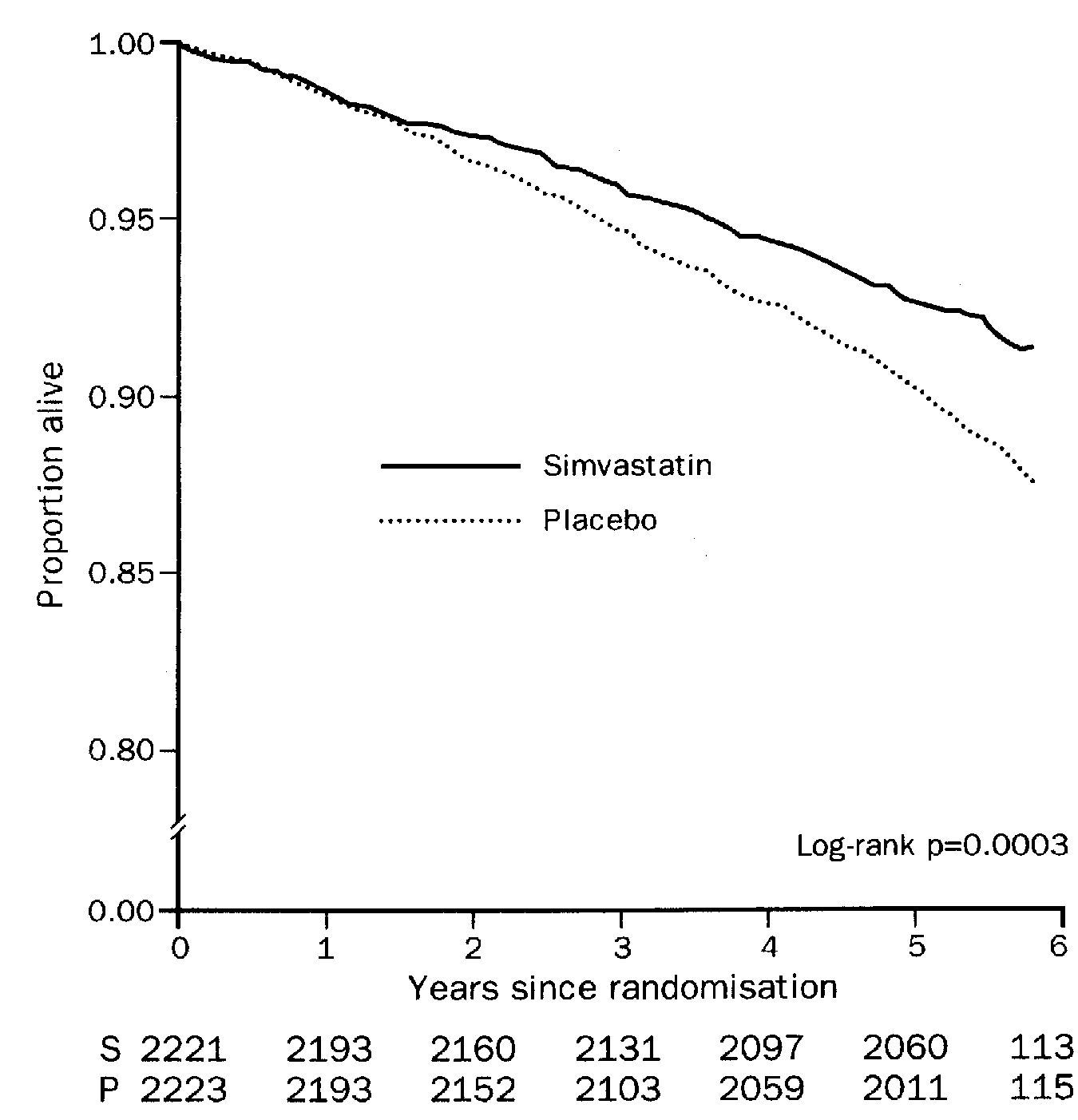
ML-236B在降低胆固醇方面的巨大潜力,吸引了更多制药公司加入开发HMG-CoA还原酶抑制剂的行列。1979年2月默克Merck公司从土曲霉菌中得到一种和ML-236B结构近似的降胆固醇药物Mevinolin,而与此同时远藤章从红曲霉菌中得到Monacolin K,之后证实Mevinolin和Monacolin K是同一种物质,并改名为洛伐他汀(Lovastatin)。1980年4月Merck开启了关于洛伐他汀的临床研究,5个月后,由于收到关于ML-236B致癌的传言,Merck紧急叫停了临床试验。尽管只进行发5个月的临床试验,但洛伐他汀给参加试验的研究人员留下了非常深刻的印象,在他们的支持下,FDA为洛伐他汀在高危人群中的临床试验打开了绿灯。 随着洛伐他汀在安全性和有效性方面的数据不断积累,1984年Merck针对高危人群启动了大规模临床研究,洛伐他汀在该项研究中表现出良好的疗效和安全性,于1987年FDA批准在美国上市。洛伐他汀开启了预防ASCVD的他汀时代。1994年在《Lancet》上发表纳入4444名冠心病患者使用辛伐他汀于生存率影响的大型临床试验。患者平均使用5.4年,与安慰剂相比辛伐他汀用药TC、LDL-C和HCL-C变化幅度分类为下降25%,下降35%和上升8%。无论在全因死亡率,冠动疾病死亡率,还是非致死性心血管事件发生率辛伐他汀都显著低于安慰剂。此后大量循证证据证实他汀类药物降低LDL-C,减少ASCVD事件发生风险的治疗意义。
影响胆固醇的合成或吸收,能够让肝细胞通过细胞表面LDL受体从血液中回收更多的LDL,以补充胆固醇的不足。他汀类药物能够显著上调肝细胞LDL受体,从而大幅降低LDL-C。在幅降低LDL-C的同时,并不降低HDL-C。对于他汀类药物与ASCVD事件发生风险之间关系的研究表明,LDL-C降幅越大,ASCVD事件的发生风险越低。尽管体内大部分胆固醇来源于肝脏合成,但仍有一部分直接来源于肠道,因此抑制胆固醇的吸收与他汀类药物联合使用,有望实现进一步降低胆固醇。1960s开发的胆酸螯合剂尽管能够阻止胆固醇的吸收,但选择性差。在他汀类药物问市后,制药企业把目光投向特异抑制胆固醇吸收的靶点——酰基辅酶A:胆固醇酰基转移酶(ACAT)。ACAT责负将游离胆固醇转化为胆固醇酯,在肠道胆固醇吸收中发挥重要作用。走在ACAT抑制剂研发前列的制药企业包括先灵葆雅Schering-Plough。1990s先灵葆雅合成一系列结构相似的ACAT抑制剂。药物筛选工作由其心血管与代谢研发部门的Harry Davis等人负责。在Harry Davis等人测定这些结构相似ACAT抑制剂体内效能的过程中,研发编号为SCH48461的化合物格外引入注目。与其它的ACAT抑制剂不同SCH48461不仅能够显著降低啮类齿动物胆固醇的吸收,对非啮齿动物吸收胆固醇也表现出很强的抑制作用。肠道内壁细胞中不仅脂化胆固醇大幅降低,游离胆固醇水平也发生显著降低。这都表明SCH48461存在更上游的作用机制。通过收集分析胆汁,确定上述作用主要依靠SCH48461的活动代谢产物。对比各种活性代谢产物在结构上的差异,为结构优化提供了主要依据。最终优化得到依折麦布(Ezetimibe),研发编号为SCH58235。关于依折麦布的作用机制直到2005年才最终阐明。其通过抑制Niemann-Pick C1 Like 1(NPC1L1)蛋白,阻止肠道对胆固醇的摄取。2002年FDA批准依折麦布在美国上市,同年依折麦布研究协作组(Ezetimibe Study Group)在《The American journal of cardiology》上发表了在他汀类药物治疗的基础上使用依折麦布的临床试验结果。该项试验共纳入769名原发性高胆固醇血症患者,治疗8周,在原他汀类药物治疗的基础上,使用有依折麦布LDL-C水平可进一步降低25.1%,而安慰剂仅为3.7%。2015年《The New England Journal of Medicine》发现表依折麦布联合辛伐他汀(Simvastatin)的IMPROVE-IT临床试验结果。该试验共纳入18,144名冠心病患者,结果显示二者联合使用平均治疗7年,与单用辛伐他汀单用相比,能够进一步降低心血管疾病事件的发生率。
除了上述主要的抗动脉粥样硬化的药物之外,一些新靶点降脂药物不断出现。如前蛋白转化酶枯草溶菌素9(PCSK9)抑制剂、微粒体TG转移蛋白抑制剂、ApoB100合成抑制剂、三磷酸腺苷柠檬酸裂解酶抑制剂、血管生成素样蛋白3抑制剂、ApoC3 抑制剂,以及用于降低Lp(a)的药物。
(校对20240621)
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3