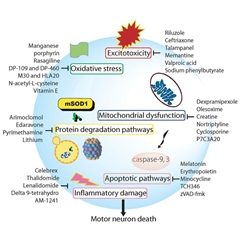
星状胶质细胞出现谷氨酸摄取障碍,神经元过度释放谷氨酸引起神经兴奋毒性,Na-K离子泵功能失调,线粒体功能失调,氧化应激,神经元内神经丝过度积累,轴突转运系统功能失调等多种因素参与到神经元损伤过程。各种神经保护剂通过不同的作用机制,减轻神经元损伤,延缓病情进展。
病理研究显示肌萎缩侧索硬化患者可见TDP-4(显示反式激活应答DNA结合蛋白-43)、SOD1(超氧化物歧化酶1)或FUS/TLS(肉瘤融合/在脂肪肉瘤转运蛋白)在神经元内出现异常沉积。而星状胶质细胞出现谷氨酸摄取障碍,神经元过度释放谷氨酸引起神经兴奋毒性,Na-K离子泵功能失调,线粒体功能失调,氧化应激,神经元内神经丝过度积累,轴突转运系统功能失调等多种因素参与到神经元损伤过程。各种神经保护剂通过不同的作用机制,减轻神经元损伤,延缓病情进展。
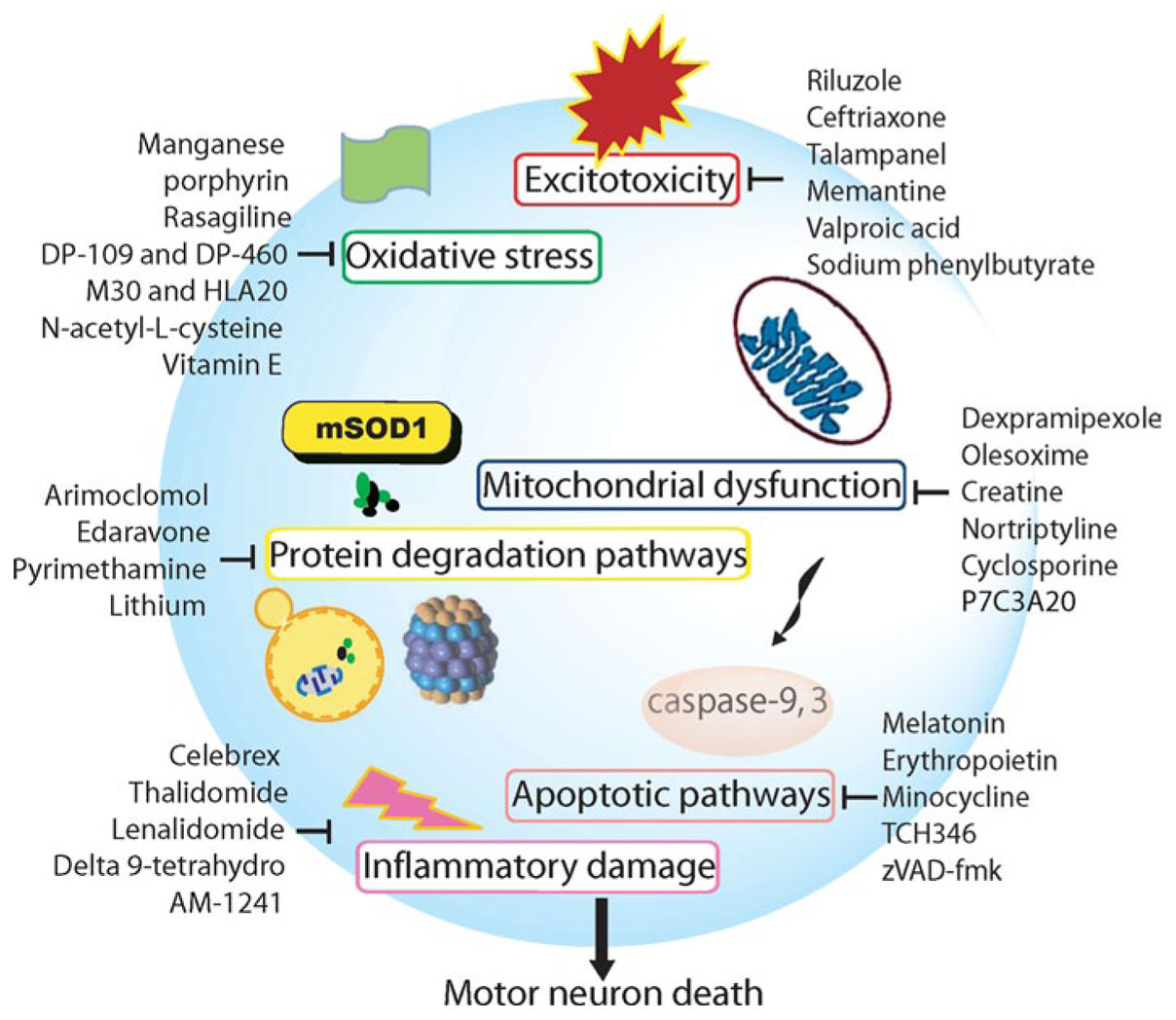
第一个被FDA批准用于治疗ALS的药物是利鲁唑(Riluzole,研发编号PK 26124)。利鲁唑由法国Pharmuka Laboratoires于1980’s原作为抗癫痫药开发。Pharmuka Laboratoires于1983年更名为 Rhône-Poulenc Rorer,现为赛诺菲Sanofi。与其它增强抑制性递质γ-氨基丁酸的抗癫痫药物不同,利鲁唑通过抑制兴奋性氨基酸神经递质谷氨酸释放发挥作用。之后利鲁唑被用于研究兴奋性氨基酸神经递质引起的神经毒性,以及作为神精保护剂用于神经损伤模型。1994年3月期《The New England Journal of Medicine》发表了利鲁唑用于ALS的临床研究结果。该试验共纳入155例ALS患者。结果显示1年后利鲁唑组生存率为74%,而安慰剂组仅为58%(P=0.014))。1995年FDA批准利鲁唑用于治疗ALS(G Bensimon., 1994)。
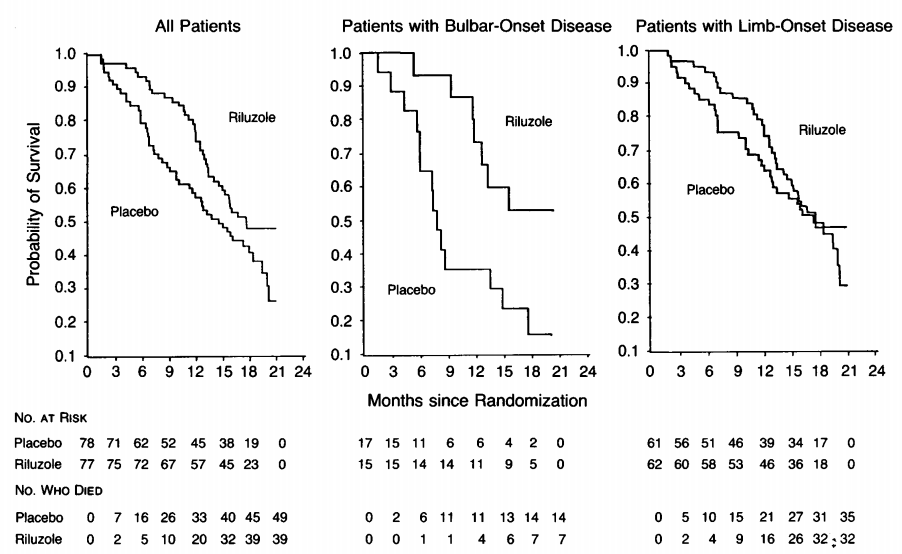
第二个被FDA批准用于治疗ALS的神经保护剂是依达拉奉(Edaravone,研发编号MCI-186),为自由基清除剂,由日本田边三菱制药(Mitsubishi Tanabe Pharma)开发,2015年获得日本批准治疗ALS,2017年获得FDA批准。在最初的3期临床研究中,依达拉奉治疗24周,在改善《ALS功能评定量表(ALSFRS-R)》评分方面未能优于安慰剂(Koji Abe., 2014)。之后对于该研究结果的分析表明由于入组ALS患者病情严重程度不同,导致ALSFRS-R评分前后变化出现较大的差异。在重新制定包括FVC(用力肺活量)%>80%,病程不超过2年,ALSFRS-R中单独每个项目评分不低2分的入组标准后,依达拉奉研究组重新启动了依达拉奉的3期临床研究。共纳入192名患者,治疗24周。试验结果显示依达拉奉组ALSFRS-R评分平均幅度为5.01,显著少于安慰剂组的7.50(p=0.0013)。(Writing Group., 2017)。
2022年9月FDA批准了Amylyx公司开发的苯基丁酸钠和牛磺熊去氧胆酸(Sodium Phenylbutyrate and Taurursodiol,研发编号AMX0035)组成的复方制剂,用于治疗ALS。苯基丁酸钠(PB)是一种芳香脂肪酸,相关研究显示PB能够改善内质网应激,调节未折叠蛋白的反应(UPR)。牛磺熊去氧胆酸(TUDCA)是牛磺酸与熊去氧胆酸结合形成的亲水性胆汁酸,研究显示TUDCA能够增强线粒体内膜的完整性。2022年9月《The New England Journal of Medicine》发表了苯基丁酸钠牛磺熊去氧胆酸治疗ALS的临床研究结果。共纳入137名病程不超过18年个月的ALS患者,治疗24个周。结果显示AMX0035组ALSFRS-R的降幅与安慰剂组相比减少2.32分(Sabrina Paganoni., 2020)。
免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
关注“药研苑”公众号,查看前景解析。

|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3