
苯基丁酸钠牛磺熊去氧胆酸(AMX0035,商品名Relyvrio)是Amylyx公司开发,用于治疗ALS的复方制剂,属于神经保护剂。苯基丁酸钠(PB)是一种芳香脂肪酸,能够改善内质网应激,调节未折叠蛋白反应(UPR)。牛磺熊去氧胆酸(TUDCA)是牛磺酸与熊去氧胆酸结合形成的亲水性胆汁酸,能够增强线粒体内膜的完整性。由于3期临床试验失败,2024年4月4日Amylyx Pharmaceuticals在线宣布Relyvrio计划退出美国及加拿大市场
结构:
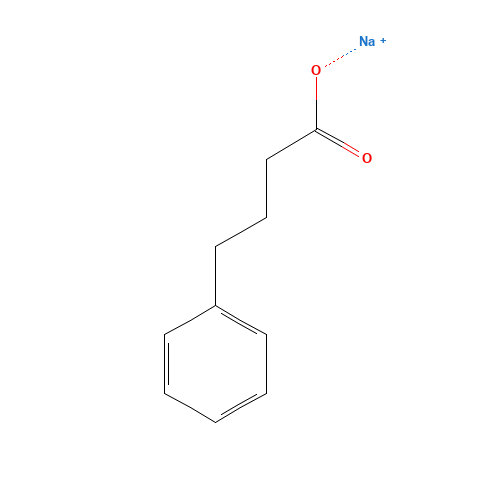
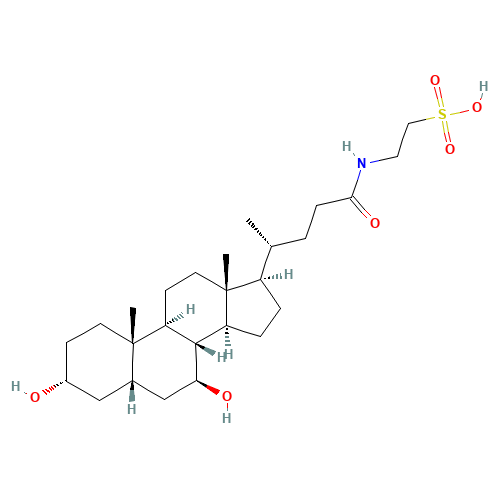
介绍:
2022年9月FDA批准了Amylyx公司开发的苯基丁酸钠和牛磺熊去氧胆酸(Sodium Phenylbutyrate and Taurursodiol,研发编号AMX0035,商品名Relyvrio)组成的复方制剂,用于治疗治疗肌萎缩侧索硬化(ALS)。
苯基丁酸钠(PB)是一种芳香脂肪酸,属于组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂。早在2004年美国哈弗医学院(Harvard Medical School)Lisa Corcoran等人就从2万种化合物中筛选发现HDAC抑制剂Scriptaid能够阻止SOD1(超氧化物歧化酶1)在神经元内发生聚集(Lisa Corcoran., 2004)。2005年美国波士顿大学医学院(Boston University School of Medicine)Hoon Ryu等人的研究显示另一种HDAC抑制剂苯基丁酸钠(PB)能够显著延长ALS模型鼠的生存时间(Hoon Ryu., 2005)。此外一此实验显示PB能够改善改善内质网应激,调节未折叠蛋白反应(UPR)。2009年《Amyotrophic Lateral Sclerosis》发表了一项由美国东北ALS和国家退伍军人ALS研究联盟发起,使用PB治疗ALS的2期临床试验结果。该研究仅初步验证了PB的安全性(Merit Cudkowicz., 2009)。PB属于非专利药物,基于历史原因缺少安全性动物实验数据,由于没有大型制药公司愿意投资开发PB,导致PB的临床研究停滞不前。
AMX0035的另一种成份牛磺熊去氧胆酸(Taurursodiol,Tauroursodeoxycholic Acid,TUDCA),是牛磺酸与熊去氧胆酸结合形成的亲水性胆汁酸。早在2000年明尼苏达大学医学院(University of Minnesota Medical School)的Cecilia Rodrigues等人就在《Journal of Neurochemistry》上发表研究文章,显示TUDCA能够增强线粒体内膜的完整性,保护神经细胞(Cecilia Rodrigues., 2000)。2004年意大利里斯本大学(University of Lisbon)Rui Castro等人在《The Journal of Pharmacology and Experimental Therapeutics》上发表研究文章,显示TUDCA能够抑制兴奋性氨基酸神经递质谷氨酸引起的神经毒性(Rui Castro., 2004)。第一个被FDA批准用于治疗ALS的药物利鲁唑(Riluzole)为谷氨酸释放抑制剂,因此不难推断出TUDCA可能有助于ALS的治疗。2008年意大利米兰Carlo Besta神经研究所(Istituto Neurologico Carlo Besta)的Alberto Albanese启动了在利鲁唑(Riluzole)的基础上使用TUDCA治疗ALS的临床试验。8年后在《European Journal of Neurology》上发表了该试验的研究结果。 共入组34名ALS患者,治疗54周。结果显示TUDCA组《ALS功能评定量表(ALSFRS-R)》评分降幅显著低于安慰剂组,并且在累积生存率方面,TUDCA显示出优于安慰剂组的治疗趋势(A E Elia., 2016)。
把PB和TUDCA联系在一起的是Amylyx公司联合创始人之一Joshua Cohen。2012年还在美国布朗大学(Brown University)读大三的生物医学工程系学生Cohen为了准备撰写一份报告,开始收集阅读与神经学有关的研究文献,并逐渐产生使用PB和TUDCA从内质网和线粒体两个方面干预ALS的想法。2013年2月28日Cohen与他的校友,Amylyx的另一位联合创始人Justin Klee在一次小型集会上讨论了他的想法。之后,Klee通过他的父母的朋友联系到辉瑞Pfizer前研究总部负责人George Milne,在和George Milne会面后,Milne鼓励他们向前推进他们的想法。在布朗大学Rudy Tanzi 的指导下 Cohen和 Klee测试了PB联合TUDCA用于过氧化氢(H2O2)介导神经细胞氧化应激的体外实验。结果显示二者联合显著优于单独使用产生的保护作用。2014年 Klee和 Cohen创立Amylyx。一次偶然机会,Tanzi介绍Klee和Cohen结识了原PB临床试验发起人美国哈弗医学院马萨诸塞州总医院(Massachusetts General Hospital)的Merit Cudkowicz。在Tanzi和Cudkowicz分别管理基金会的帮助下Klee和 Cohen启动了AMX0035的毒理实验。之后在Morningside Ventures 晨兴创投和 美国ALS协会(The ALS Association)ALS加速开发项目( ALS Accelerated Therapeutics Initiative)的资助下,Amylyx启动了AMX0035的2期临床试验。试验结果于2022年9月由美国马萨诸塞州总医院的Sabrina Paganoni在《The New England Journal of Medicine》发表。该项试验共纳入137名病程不超过18年个月的ALS患者,治疗24个周。结果显示AMX0035组ALSFRS-R的降幅与安慰剂组相比减少2.32分(p=0.03)(Sabrina Paganoni., 2020)。Paganoni同年在《Muscle & Nerve》上发表了AMX0035对ALS生存时间影响的研究结果。与安慰剂组相比AMX0035组平均中位数生存时间延长了6.5个月(Sabrina Paganoni., 2020)。
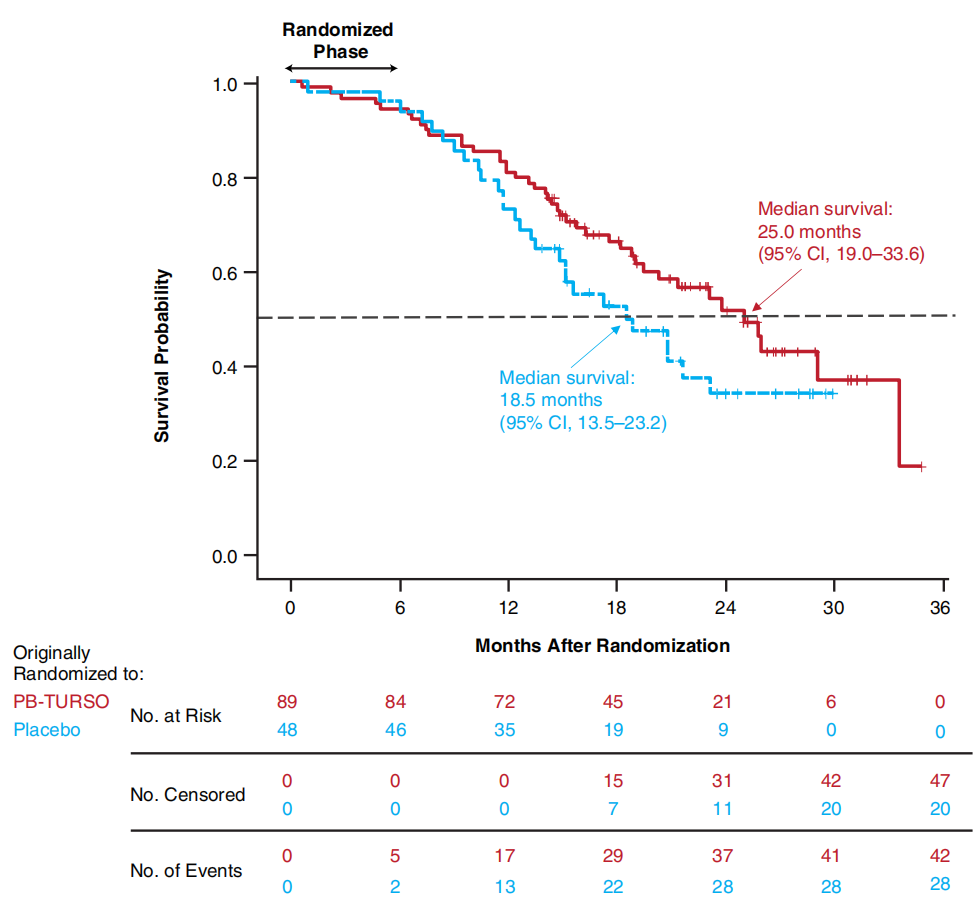
2024年3月8日Amylyx Pharmaceuticals在线宣布Relyvrio治疗ALS的3期临床研究PHOENIX试验失败。试验结果显示在第48周时,接受AMX0035治疗组与安慰剂组相比改善ALSFRS-R评分相对于基线变化方面没有显著差异(p=0.667)(2024., Amylyx Pharmaceuticals)。
PHOENIX是一项为期48周的全球随机、安慰剂对照、3期多中临床试验,用于进一步评估AMX0035治疗ALS的安全性和有效性。共纳入664名ALS的成年人随机进入AMX0035的两个剂量组或安慰剂组。该试验主要结终点指标为第48 周时《ALS功能评分量表(ALSFRS-R)》评分相对于基线的变化。次要终点指标包括患者生活质量结果评分、总生存期和慢肺活量(SVC)。该试验还对AMX0035的了安全性和耐受性进行评估。
基于上述研究结果,2024年4月4日Amylyx Pharmaceuticals在线宣布Relyvrio计划退出美国及加拿大市场(2024., Amylyx Pharmaceuticals)。

免责声明:相关信息仅限药物研发参考使用,本网站不保证信息真实和准确!
|
推荐阅读: ・2025年1-3季度口崩片市场哪个强? ・2025年1-3季度口溶膜制剂哪家强? ・免疫检查点抑制剂,谁将成为下一个王者? ・质子泵相关抑酸类药物市场即将回暖 ・中药1类新药距离封神还有多远 |
|
“药品营销避坑”试读: ・药品立项需要注意什么(一) ・药品生命周期管理(一) ・改剂型,口服液体制剂“金矿”还是“陷阱 |
关注“药研苑”公众号,及时掌握最新的药物研发动态。
我们提供如下咨询服务:药品信息发布、药品立项、市场前景分析、医院及药品零售市场分析、药品市场调研及制定推广策略、国外药品引进、国内批文转让、上市前后临床试验设计、药品彩页及主图设计、药品推广PPT制作。您可以关注公众号“药研苑”后,在主页面发送消息,咨询相关服务。

横切线®为注册商标
Copyright 2020 横切线®药研苑 备案号:粤ICP备18041379号-3